Акадезин (AICAR) – близкий аналог аденозина с высокой биоактивностью. В данном обзоре рассмотрены результаты ключевых биологических испытаний препарата как потенциального лекарства при ишемии, коронарном шунтировании, онкологии и др. Также рассмотрены аспекты немедицинского применения акадезина в качестве допингового агента, повышающего выносливость спортсменов.
Общая характеристика акадезина
Акадезин [AICAR (в русской транскрипции иногда неверно называется АЙКАР, правильное сокращение – АИКАР) AICA-рибозид, 1-β-D-рибофуранозид, Acadesine, Acadra, N1-(β-D-рибофуранозил)-5-аминоимидазол-4-карбоксамид; брутто-формула C9H14N4O5; СAS 2627-69-2] – встречающаяся в природе молекула, которая принадлежит к таким классам органических соединений, как имидазол-рибонуклеозиды и рибонуклеотиды.
Структура препарата характеризуется тем, что атом углерода C-1 рибозильной группы связан с имидазольным кольцом по атому азота, тогда как нуклеотиды несут фосфатную группу, связанную с атомом углерода C5 рибозной (или дезоксирибозной) части. Акадезин является предшественником и близким аналогом аденозина, но не содержит пуринового фрагмента (Рис. 1), что обуславливает его высокую биологическую активность, поскольку аденозин участвует во многих биохимических процессах, включая передачу энергии (в фосфорилированном виде – АТФ и АДФ) и нервных импульсов (циклический аденозинмонофосфат, цАМФ). Акадезин при введении в организм млекопитающего быстро фосфорилируется и вовлекается в клеточный метаболизм [1].
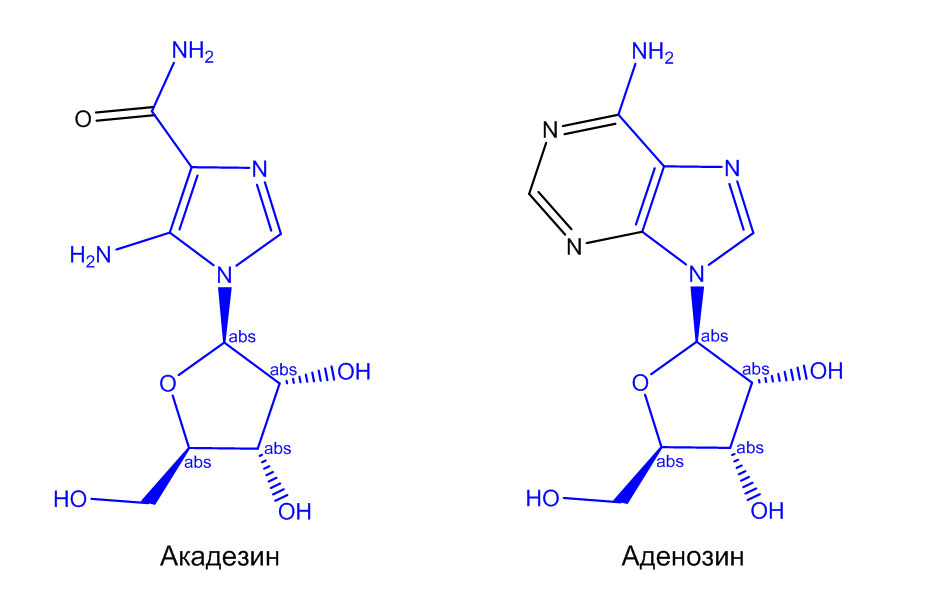
Рисунок 1 – Структурные формулы акадезина и аденозина
Синтетический акадезин был впервые получен в 1985 году путем пятистадийного синтеза, исходя из защищенной по гидрокси-группам 2-бромрибозы и диаминомалононитрила [2]. Последние годы в качестве наиболее эффективного и удобного способа получения препарата применяют биосинтетические подходы, как, например, разработанный в «ГосНИИгенетика» (Москва) в рамках программы «ФАРМА 2020» и основанный на создании продуцента – рекомбинантного штамма Сенной палочки (Bacillus subtilis), его культивировании и последующим выделении субстанции с чистотой ≥98% [3]. Несмотря на наличия множества функциональных групп, акадезин является стабильным веществом и может храниться в кристаллическом виде до полутора лет даже при 40 ⁰С [4]. Акадезин представляет собой активатор клеточной протеинкиназы, регулирующей внутриклеточный энергетический баланс (AMPK) [5].
Терапевтическое применение акадезина обусловлено тем, что патологические процессы, вызывающие нарушения действия AMPK, могут являться причиной возникновения таких опасных состояний, как гипертония, ишемия, рак, болезнь Альцгеймера, ожирение и диабет. В основе патологий, как правило, лежит образ жизни пациентов, включающий недостаток физических нагрузок и неправильное, избыточное питание. Далее мы рассмотрим некоторые другие примеры исследований акадезина.
Безопасность, переносимость и фармакокинетика препарата впервые были оценены в 1991 году [1]. На четверых добровольцах было показано, что акадезин безопасен при пероральном и внутривенном введении в диапазоне дозировок 10–100 мг/кг, причем авторы подчеркивают низкую биодоступность при пероральном приеме. 48% общей дозы выводится с мочой и калом в течение 2 недель (из них 44% – с мочой) [6]. Мочевая кислота была основным метаболитом в моче вместе с небольшим количеством гипоксантина. Препарат незначительно связывается с белками (приблизительно 1%), а период полувыведения составляет 1 неделю [1].
Антиишемическая активность акадезина
Акадезин обладает антиишемическими свойствами. Препарат находился в фазе III клинических исследований по предотвращению неблагоприятных сердечно-сосудистых исходов у пациентов, перенесших операцию по аортокоронарному шунтированию (АКШ). Разработку и изучение проводили совместно компании PeriCor и Schering-Plough. Препарат рассматривали как первый представитель средств для предотвращения реперфузионного повреждения во время проведения АКШ. Schering-Plough начала исследование фазы III в 2009 году, которое было прекращено в конце 2010 года на основании промежуточного анализа, показавшего низкую эффективность акадезина [7].
За счет избирательного увеличения доступности аденозина в ишемизированных тканях, акадезин снижает ишемическое повреждение миокарда, что было продемонстрировано на пациентах, перенесших операцию по аортокоронарному шунтированию (АКШ) [8]. Цели исследования заключались в оценке безопасности и влияния акадезина на ишемию миокарда, функцию левого желудочка и, во вторую очередь, на неблагоприятные клинические исходы (инфаркт миокарда, сердечная недостаточность, опасные для жизни нарушения ритма и смерть) у пациентов. 116 пациентов, перенесших операцию АКШ, были рандомизированы для изучения двойным слепым методом одного из трех режимов непрерывного внутривенного введения: плацебо (контроль) или одна из доз акадезина (инфузия высокой или низкой дозы) во время операции и в раннем послеоперационном периоде (общее время инфузии составляло 7 ч). Для защиты миокарда использовали многодозовую холодную кристаллоидную кардиоплегию (введение кардиопротекторного состава), каждая из которых содержала акадезин или плацебо. Наличие ишемии миокарда оценивали с помощью непрерывной холтеровской электрокардиографии (ЭКГ) и чреспищеводной эхокардиографии (ЧЭ). Все пациенты получали стандартизированное лечение. Введение акадезина было безопасным: умеренное повышение мочевой кислоты в плазме (метаболита акадезина) наблюдалось только у пациентов, получавших высокие дозы (среднее увеличение на 1,6–0,2 мг/дл), и не имело клинических последствий. Перед введением препарата в предоперационном периоде (исходный уровень) частота и тяжесть ишемии ЭКГ не различались между тремя группами (плацебо = 18%; низкая доза = 14%; высокая доза = 14%). Во время предварительного шунтирования частота ишемии ЭКГ была одинаковой во всех трех группах (0%, 3% и 3%, соответственно). Частота ишемии была численно ниже в двух группах с применением акадезина (высокая доза = 6%, низкая доза = 15%), чем в контрольной группе (19%), но статистическая значимость оказалась низкой. Во время постшунтирования частота ишемии по ЭКГ составляла 11% в группе высокой дозы, 22% в группе низкой дозы и 18% в контрольной группе. Средняя продолжительность эпизодов ишемии на ЭКГ после шунтирования была короче в группе высокой дозы (36±20 мин), чем в группе группы плацебо (175±156 мин) или низких доз (125±80 мин). Частота неблагоприятных сердечных исходов составила 5% как в группах низких, так и высоких доз, по сравнению с 14% в группе плацебо. Так, авторами показано, что акадезин ограничивает тяжесть ишемии миокарда после шунтирования, что подтверждается более короткой продолжительностью ишемии у пациентов, получающих высокие дозы акадезина [8].
В другом исследовании влияние акадезина, аденозин-регулирующего агента, на частоту инфаркта миокарда и других неблагоприятных сердечно-сосудистые исходов оценивалась у 821 пациента, перенесших коронарную болезнь сердца и шунтирование артерии [9]. Пациенты были проспективно разделены на группу высокого риска (возраст >70 лет, нестабильная стенокардия, предшествующее коронарное шунтирование, безуспешная ангиопластика или фракция выброса <30%) или группу низкого риска. Субъекты были рандомизированы двойным слепым методом на группы введения плацебо (n = 418) или акадезина (n = 403) путем внутривенной инфузии в течение 7 часов (0,1 мг/кг в минуту) и в кардиоплегический раствор (плацебо или 5 мкг/мл акадезина). Акадезин не оказал значительного влияния на частоту инфаркта миокарда в общей популяции, но значительно снизил частоту инфаркта миокарда у пациентов с высоким риском (плацебо – 19,7%; акадезин – 10,0%;). Частота всех неблагоприятных сердечно-сосудистых исходов (плацебо – 19,4%; акадезин – 18,4%) и общая смертность (плацебо – 3,4%; акадезин – 2,7%) были близкими между обеими группами. Тем не менее, акадезин снизил частоту сердечных событий, которые способствовали смерти в течение первых трех послеоперационных дней, так что частота летальных исходов в этот период была ниже (плацебо – 1,9%; акадезин – 0,2%). Вторичный анализ в проспективно определенной подгруппе высокого риска предполагает, что акадезин может быть полезным для некоторых пациентов [9].
Противораковое действие акадезина
Акадезину присвоен статус орфанного препарата для лечения хронического лимфолейкоза у взрослых (B-CLL) в странах Европейского Союза [10, 11]. Было показано, что акадезин избирательно индуцирует апоптоз, т. е., гибель B-клеток, взятых у пациентов с B-CLL, и слабо влияет на T-клетки. Поскольку Т-клетки играют важную роль в борьбе с инфекциями, ожидалось, что пациенты, получающие акадезин, будут иметь меньший риск серьезных инфекций по сравнению с пациентами, получающими обычную химиотерапию.
Механизм, с помощью которого акадезин избирательно убивает В-клетки, еще не полностью выяснен, однако известно, что действие акадезина не требует присутствия белка-супрессора опухолей р53, как при других методах лечения. Это важно, поскольку в раковых B-клетках p53 часто отсутствует или имеет серьезные дефекты. Исследования показали, что акадезин активирует AMPK и вызывает апоптоз B-клеток при хроническом лимфоцитарном лейкозе, не затрагивая Т-лимфоциты; полумаксимальная эффективная концентрация (ЕС50) для клеток B-CLL, взятых от пациентов, in vitro составляет 380±60 мкМ [12]. Выживаемость опухолевых клеток при концентрации 0,5 мМ акадезина в течение 24 часов снизилась с 68±12% до 26±12%.
В 2013 году на основе акадезина «ГосНИИгенетика» запатентовала лечебное средство с противоопухолевой активностью, в котором препарат сочетали с НСПВП (аспирин, ибупрофен, индометацин) [13]. Предложенное изобретение оказалось эффективным на мышиной модели В-клеточного лейкоза (клеточная линия Р388) при концентрации компонентов по10 мМ в ДМСО (в случае аспирина – 100 мг/мл). Явный синергизм наблюдался при комбинации 1,5–3 мкМ акадезина и индометацина в концентрации 0,1 мМ. Применение 3 мкМ акадезина в сочетании с 0,4 мМ ибупрофена, каждый из которых в индивидуальном виде не проявлял цитотоксичность, вызывало гибель 61% опухолевых клеток. В экспериментах in vivo акадезин применяли внутрибрюшинно по 60 мг/кг, параллельно с пероральным введением 200 мг/кг аспирин в течение 10 дней. Такая терапия вызывала торможение роста опухоли %ТРО=73, что указывает на выраженную противоопухолевую активность [13].
Также важно, что акадезин подавляет устойчивость к азацитидину при миелодиспластическом синдроме и остром миелоидном лейкозе [14]. В клиническом исследовании фазы I/II на 12 пациентах использовали акадезин под торговым наименованием Acadra® курсами по 28–56 дней с нарастающей дозировкой . Несмотря на очень хороший ответ у одного из 4 пациентов, авторы прекратили испытание, потому что самая высокая доза акадезина (210 мг/кг) вызвала серьезные побочные эффекты со стороны почек у нескольких пациентов; количество опухолевых клеток при это снижалось на ~20% у двух из трех пациентов. Следует отметить, что побочные эффекты высоких доз акадезина исключают его использование у пациентов с серьёзными сопутствующими заболеваниями.
В экспериментах in vitro акадезин проявляет активность при гипоксии опухолей (1% кислорода) и подавляет пролиферацию, вызывая апоптоз клеток аденокарциномы молочной железы (HCC1395 и MCF-7 при концентрации полумаксимального ингибирования IC50=0,86 мМ и IC50=0,28 мМ акадезина, соответственно), включая клеточные линии трижды негативного рака (MDA-MB-231 при IC50=0,05 мМ) [15]. При этом, препарат проявлял цитотоксичность и снижал устойчивость опухолевых клеток по отношению к цисплатину. Сочетание цисплатина с акадезином оказалось действенным также и при нормальной концентрации кислорода (21%) – через 72 ч инкубации гибло более 70% раковых клеток.
Акадезин в концентрации 0,25–1,0 мМ активирует стресс-зависимый апоптоз эндоплазматического ретикулума в раковых клетках желчного пузыря человека с гибелью до 80% клеток, но в этом случае механизм не зависит от AMPK, что было показано на клеточных линиях GBC-SD, Mz-ChA-1 и QBC9 [16]. И наоборот, препарат индуцирует митохондриальный апоптоз в клетках остеосаркомы человека in vitro на клеточных линиях MG63 и KHOS, и in vivo (на мышах с привитыми опухолями) посредством AMPK-зависимого пути [17]. Введение акадезина в дозе 450 мг/кг проводили путем внутрибрюшинной инъекции, начиная через 1 неделю после имплантации клеток и повторяли ежедневно в течение двух недель. В конце эксперимента объем опухоли в группах, получавших акадезин, составлял 85,9% (для MG63) и 64,6% (для KHOS) от объема опухолей в каждой контрольной группе. Значительной потери массы тела не наблюдалось в течение экспериментального периода ни на одной из моделей остеосаркомы.
Акадезин – допинг для повышения выносливости
В 2007 году было выявлено, что активация AMP-активированной протеинкиназы (AMPK) в мышцах при введении акадезина, как и при физической нагрузке, увеличивает поглощение глюкозы [18]. В исследовании приняли участие 29 здоровых мужчин (возраст 26±8 лет, ИМТ 25±4 кг/м2). Скорость поглощения мышечной 2-дезоксиглюкозы (2DG) определяли путем измерения накопления общей мышечной 2DG (2DG и 2DG-6-фосфат) во время непрерывной инфузии 2DG. Удаление глюкозы сравнивалось до и во время введения препарата с помощью эугликемико-гиперинсулинемического зажима. Поглощение 2DG мышцами было линейным в течение 9 часов, причем через 3 часа потребление 2DG увеличилось в 2,1 и 4,7 раза в ответ на акадезин или применение велотренажера, соответственно. Активность AMPK не изменилась через 20 минут или 3 часа после введения препарата, но фосфорилирование AMPK значительно увеличилось сразу и через 3 часа после тренировки на велотренажере. Среднее удаление глюкозы во всем организме увеличилось на 7% под действием акадезина с 9,3 до 10 мг•кг-1•мин-1. Таким образом, акадезин у здоровых людей резко стимулирует поглощение 2DG мышцами с некоторым влиянием на расход глюкозы организмом [18]. Акадезин действует как агонист AMP-активируемой протеинкиназы [19]. Благодаря этому, препарат стимулирует поглощение глюкозы и увеличивает активность митоген-активируемых α и β протеинкиназ p38 в тканях скелетных мышц [20], а также подавляет апоптоз за счет снижения выработки кислородных радикалов внутри клетки [21].
Примечательной является работа 2008 года, выполненная в независимом Институте биологических исследований Солка (Salk Institute for Biological Studies, Сан-Диего, Калифорния, США) [22]. Авторы проверили влияние препаратов на выносливость мышей в тесте «бег на беговой дорожке» (10 м/мин в течение 15 мин через день в течение 1 недели) и обнаружили, что агонист PPARβ/δ b и тренировка с физической нагрузкой синергетически увеличивают у взрослых мышей выносливость при беге. В другом эксперименте самцам мышей вводили GW1516 (5 мг/кг/день, через желудочный зонд), акадезин (250 мг/кг/день, внутрибрюшинно) или комбинацию двух препаратов на протяжении 6 дней для изучения экспрессии генов. Кроме того, мышам также вводили акадезин (500 мг/кг/день, внутрибрюшинно) в течение 4 недель для проведения тестов на беговой дорожке. По истечении 4 недель все тренированные мыши бегали по 50 мин/день со скоростью 18 м/мин. Поскольку тренировка активирует AMPK и PGC1α, авторы затем проверили, может ли акадезин при пероральном введении быть достаточным для преодоления потребности в физических упражнениях. Неожиданно, даже у мышей, ведущих малоподвижный образ жизни, 4 недели обработки только лишь с помощью акадезина активировало метаболические гены и повысило беговую выносливость на 22–44%. Полагают, что эффект достигается благодаря трансформации мышечных волокон в их более энергоэффективную форму. Сочетание GW501516 с акадезином активировало ~40% генов у мышей, не получавших физическую нагрузку, что было сопоставимо с изменениями у тренированных мышей [22]. В 2011 году было обнаружено, у мышей, страдающих ожирением, краткосрочное (2 недели) ежедневное введение акадезина нормализовало их гиперактивную передачу сигналов mTOR в состоянии натощак [23]. Наряду с ожидаемым снижением концентрации глюкозы и инсулина в циркулирующей крови, а также содержания липидов и гликогена в мышцах после терапии, у мышей, получавших препарат, значительно увеличились трансляционная способность и масса комплекса подошвенных сгибателей, включая области мышечных волокон. Авторы полагают, что окислительный метаболизм, емкость мышцы и регуляторные процессы роста мышц (mTOR и контроль трансляции) нормализовались, вызвав рост инсулинорезистентных (например, страдающих ожирением или состарившихся) мышц. Таким образом, получение контроля над этими сигнальными путями и процессами с помощью антагонистов mTOR может быть полезным для лечения саркопении и связанных с ней дисфункций.
Высокое потребление насыщенных жиров приводит к развитию гипертонии, в патогенезе которой участвует AMPK. На беременных крысах, получавших обычную пищу или диету с высоким содержанием насыщенных жиров на протяжении всей беременности и кормления грудью, внутрибрюшинное введение акадезина в дозе 50 мг/кг дважды в день в течение 3 недель на протяжении периода беременности или периода лактации защищало потомство мужского пола от гипертонии и окислительного стресса, вызванного избыточным потреблением жиров [24]. Благоприятные эффекты терапии во время беременности связаны с восстановлением уровней NO.
Даже ранние результаты по действию акадезина на мышцы подопытных животных немедленно вызвали рост интереса к препарату как к потенциальному допингу для повышения выносливости у спортсменов. Уже в 2009 году появилось сообщение, что акадезин применяли велосипедисты во время шоссейной многодневной велогонки «Тур де Франс» [25]. Это подтвердило необходимость включения препарата в программы допинг-контроля, как и тот факт, что это вещество легко доступно в качестве химического реактива и у Интернет-поставщиков [26]. Ожидаемо, Всемирное антидопинговое агентство (ВАДА) внесло акадезин в Список запрещенных препаратов [27].
Из-за естественного присутствия акадезина в моче человека для получения доказательств незаконного использования неутвержденного лекарственного препарата потребовались сложные аналитические стратегии, аналогичные подходам, используемым для обнаружения применения эндогенных стероидов. Посредством тандемной масс-спектрометрии и жидкостной хроматографии (LC-IDMS/MS) естественные концентрации акадезина в моче были количественно определены в группе из 499 спортсменов, демонстрируя значительную корреляцию его уровней в моче с полом, типом спорта (например, виды спорта на выносливость и силовой спорт) и моментом времени взятия пробы (т. е., до или вне соревнований). Было зарегистрировано среднее значение примерно 2200 нг/мл, и с учетом другой серии из 500 проб мочи, собранных у спортсменов-любителей, был предложен предварительный пороговый уровень 3500 нг/мл [26]. Тем не менее, превышение концентраций акадезина в моче над контрольными значениями не позволит доказать злоупотребление синтетическим акомдезина, в частности, из-за существенных внутри- и межиндивидуальных вариаций [26]. Однако злоупотребление можно определить косвенными методами по контролю эндогенного вещества у конкретного спортсмена. Позже, при анализе 12377 образцов было установлено, что средняя концентрация акадезина в моче человека составила 647±365 нг/мл со средним значением 574 нг/мл, 99-ый процентилем 1786 нг/мл и 99,7 процентилем 2151 нг/мл [28]. Основываясь на этих результатах, предлагается анализировать любой образец с концентрацией акадезина более 2000 или 2500 нг/мл с помощью масс-спектрометрии по соотношению изотопов углерода для установления происхождения препарата.
Тем не менее, акадезин (часто – под некорректным названием Айкар) широко доступен в Интернет-магазинах, торгующих БАД и допинг-препаратами для спортсменов. В описаниях продавцов он позиционируется, несмотря на недостаточную изученность, как эффективный препарат для повышения выносливости и производительности, причем не требующий увеличения продолжительности или интенсивности тренировок, с, якобы, «доказанным рост выносливости на 50% по сравнению с обычным уровнем» при введении через день в дозировке ~25 мг или по 10 мг в комбинации с GW1516. Потенциальным потребителям следует с осторожностью относиться к таким рекомендациям, а также учитывать, что вещество внесено в запретный список ВАДА [27].
Заключение
Из приведенных результатов исследований вытекает, что акадезин является интересным препаратом с широким спектром биологической активности. Потенциальная сфера его применения затрагивает лечение онкологических и сердечно-сосудистых заболеваний, диабета, ожирения, саркопении и сопутствующих нарушений. Безопасность препарата и родство его структуры с природными соединениями позволяют широко варьировать дозировку акадезина, а также комбинировать его с другими лекарственными средствами. Возможно, что акадезин может найти применение и в терапии новой коронавирусной инфекции, всемирная пандемия которой не стихает на протяжении текущего год. Однако к настоящему времени препарат и механизмы его действия все еще недостаточно изучены и необходимость дальнейших исследований остается актуальным вопросом. Небезынтересной является информация, что при помощью компьютерного дизайна в рамках исследования возможности перепрофилирования уже известных препаратов на лечение коронавирусной инфекции, вызываемой SARS-CoV-2, акадезин отвечает заданным авторами параметрам, хорошо вписывается в связывающий карман белка вируса и способен ингибировать его in vitro [29].
Лигандрол (Ligandrol, LGD-4033, SARM,САРМ)
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
Радарин (Radarine, RAD-140, SARM, САРМ)
Ибутаморен (Ibutamoren, MK-677)
No post found!
Реверол, Рекардин и другие лиганды рецептора REV-ERB. При дистрофии и для регенерации мышц
Таблетки – заменители физических упражнений
Миноксидил от облысения. Местное и пероральное применение
Ноотропы оксирацетам и прамирацетам
Уролитин А (Urolithin A). Мышечная дистрофия и старение
Реверол, Рекардин и другие лиганды рецептора REV-ERB. При дистрофии и для регенерации мышц
5-amino-1MQ
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
1. Dixon, R., Gourzis, J., McDermott, D., Fujitaki, J., Dewland, P., Gruber, H., AICA-Riboside: Safety, Tolerance, and Pharmacokinetics of a Novel Adenosine-Regulating Agent. The Journal of Clinical Pharmacology, 1991. 31(4): p. 342-347. DOI: 10.1002/j.1552-4604.1991.tb03715.x.
2. Ferris, J.P., Devadas, B., Huang, C.H., Ren, W.Y., Nucleosides from carbohydrate adducts of diaminomaleonitrile. A novel synthesis of 5-amino-1-(.beta.-D-ribofuranosyl)imidazole-4-carboxamide and 5-amino-1-(.beta.-D-ribopyranosyl)imidazole-4-carboxamide. The Journal of Organic Chemistry, 1985. 50(6): p. 747-754. DOI: 10.1021/jo00206a004.
3. Лобанов, К.В., Шакулов, Р.С., Яроцкий, С.В., Глазунова, В.А., Смирнова, З.С., Штиль, А.А., Миронов, А.С., Биосинтетический акадезин-основа для создания перспективного противоопухолевого препарата. Российский биотерапевтический журнал, 2012. 11(2): p. 33.
4. Куваев, Т.А., Антонова, С.В., Демина, Н.Г., Румянцева, Н.Ф., Изучение стабильности кристаллов и растворов акадезина при хранении. Биотехнология. Теоретический и научно-практический журнал, 2018. Спецвыпуск: p. 91.
5. Favero, C.B., Mandell, J.W., A pharmacological activator of AMP-activated protein kinase (AMPK) induces astrocyte stellation. Brain Research, 2007. 1168: p. 1-10. DOI: https://doi.org/10.1016/j.brainres.2007.06.087.
6. Dixon, R., Fujitaki, J., Sandoval, T., Kisicki, J., Acadesine (AICA-riboside): disposition and metabolism of an adenosine-regulating agent. The Journal of Clinical Pharmacology, 1993. 33(10): p. 955-958. DOI: 10.1002/j.1552-4604.1993.tb01929.x.
7. «Research and Development Update». Merck & Co., Inc. . 2010; Available from: https://www.sec.gov/Archives/edgar/data/310158/000095012310074336/y83714e10vq.htm#002.
8. Leung, J.M., Stanley, T., Mathew, J., Curling, P., Barash, P., Salmenpera, M., Reves, J.G., Hollenberg, M., Mangano, D.T., An initial multicenter, randomized controlled trial on the safety and efficacy of acadesine in patients undergoing coronary artery bypass graft surgery. SPI Research Group. Anesthesia and analgesia, 1994. 78(3): p. 420-434. DOI: 10.1213/00000539-199403000-00002.
9. Menasché, P., Jamieson, W.R., Flameng, W., Davies, M.K., Acadesine: a new drug that may improve myocardial protection in coronary artery bypass grafting. Results of the first international multicenter study. Multinational Acadesine Study Group. Journal of Thoracic and Cardiovascular Surgery, 1995. 110(4 Pt 1): p. 1096-1106. DOI: 10.1016/s0022-5223(05)80179-5.
10. Acadesine. DB04944. Logo white. 2020; Available from: https://www.drugbank.ca/drugs/DB04944.
11. Cronstein, B.N., Kamen, B.A., 5-Aminoimidazole-4-Carboxamide-1-β-4-Ribofuranoside (AICA-riboside) as a Targeting Agent for Therapy of Patients With Acute Lymphoblastic Leukemia: Are We There and Are There Pitfalls? Journal of Pediatric Hematology/Oncology, 2007. 29(12).
12. Campàs, C., Lopez, J.M., Santidrián, A.F., Barragán, M., Bellosillo, B., Colomer, D., Gil, J., Acadesine activates AMPK and induces apoptosis in B-cell chronic lymphocytic leukemia cells but not in T lymphocytes. Blood, 2003. 101(9): p. 3674-3680. DOI: 10.1182/blood-2002-07-2339.
13. RU 2494744 C1, 2013.
14. Cluzeau, T., Furstoss, N., Savy, C., El Manaa, W., Zerhouni, M., Blot, L., Calleja, A., Dufies, M., Dubois, A., Ginet, C., Mounier, N., Garnier, G., Raynaud, S., Rohrlich, P.S., Peterlin, P., Stamatoullas, A., Chermat, F., Fenaux, P., Jacquel, A., Robert, G., Auberger, P., Acadesine Circumvents Azacitidine Resistance in Myelodysplastic Syndrome and Acute Myeloid Leukemia. International Journal of Molecular Sciences, 2020. 21(1). DOI: 10.3390/ijms21010164.
15. Щербаков, А.М., Вавилов, Н.Э., Андреева, О.Е., Тяглов, Б.В., Миронов, А.С., Шакулов, Р.С., Лобанов, К.В., Яроцкий, С.В., Штиль, А.А., Действие акадезина на клетки рака молочной железы в условиях гипоксии. Успехи молекулярной онкологии, 2017. 4(1): p. 60-64. DOI: https://doi.org/10.17650/2313-805X-2017-4-1-60-64.
16. Nie, J., Liu, A., Tan, Q., Zhao, K., Hu, K., Li, Y., Yan, B., Zhou, L., AICAR activates ER stress-dependent apoptosis in gallbladder cancer cells. Biochemical and Biophysical Research Communications, 2017. 482(2): p. 246-252. DOI: https://doi.org/10.1016/j.bbrc.2016.11.050.
17. Morishita, M., Kawamoto, T., Hara, H., Onishi, Y., Ueha, T., Minoda, M., Katayama, E., Takemori, T., Fukase, N., Kurosaka, M., Kuroda, R., Akisue, T., AICAR induces mitochondrial apoptosis in human osteosarcoma cells through an AMPK-dependent pathway. International Journal of Oncology, 2017. 50(1): p. 23-30. DOI: 10.3892/ijo.2016.3775.
18. Cuthbertson, D.J., Babraj, J.A., Mustard, K.J.W., Towler, M.C., Green, K.A., Wackerhage, H., Leese, G.P., Baar, K., Thomason-Hughes, M., Sutherland, C., Hardie, D.G., Rennie, M.J., 5-Aminoimidazole-4-Carboxamide 1-β-D-Ribofuranoside Acutely Stimulates Skeletal Muscle 2-Deoxyglucose Uptake in Healthy Men. Diabetes, 2007. 56(8): p. 2078-2084. DOI: 10.2337/db06-1716.
19. Corton, J.M., Gillespie, J.G., Hawley, S.A., Hardie, D.G., 5-aminoimidazole-4-carboxamide ribonucleoside. A specific method for activating AMP-activated protein kinase in intact cells? The European Journal of Biochemistry, 1995. 229(2): p. 558-565. DOI: 10.1111/j.1432-1033.1995.tb20498.x.
20. Lemieux, K., Konrad, D., Klip, A., Marette, A., The AMP-activated protein kinase activator AICAR does not induce GLUT4 translocation to transverse tubules but stimulates glucose uptake and p38 mitogen-activated protein kinases α and β in skeletal muscle. The FASEB Journal, 2003. 17(12): p. 1658-1665. DOI: 10.1096/fj.02-1125com.
21. Kim, J.-E., Kim, Y.-W., Lee, I.K., Kim, J.-Y., Kang, Y.J., Park, S.-Y., AMP-Activated Protein Kinase Activation by 5-Aminoimidazole-4-carboxamide-1-β-2D-ribofuranoside (AICAR) Inhibits Palmitate-Induced Endothelial Cell Apoptosis Through Reactive Oxygen Species Suppression. Journal of Pharmacological Sciences, 2008. 106(3): p. 394-403. DOI: 10.1254/jphs.FP0071857.
22. Narkar, V.A., Downes, M., Yu, R.T., Embler, E., Wang, Y.-X., Banayo, E., Mihaylova, M.M., Nelson, M.C., Zou, Y., Juguilon, H., Kang, H., Shaw, R.J., Evans, R.M., AMPK and PPARδ Agonists Are Exercise Mimetics. Cell, 2008. 134(3): p. 405-415. DOI: 10.1016/j.cell.2008.06.051.
23. Williamson, D.L., Drake, J.C., Normalizing a hyperactive mTOR initiates muscle growth during obesity. Aging, 2011. 3(2): p. 83-84.
24. Tsai, W.-L., Hsu, C.-N., Tain, Y.-L., Whether AICAR in Pregnancy or Lactation Prevents Hypertension Programmed by High Saturated Fat Diet: A Pilot Study. Nutrients, 2020. 12(2): p. 448. DOI: https://doi.org/10.3390/nu12020448.
25. Benkimoun, P., Police find range of drugs after trawling bins used by Tour de France cyclists. The BMJ, 2009. 339: p. b4201. DOI: 10.1136/bmj.b4201.
26. Thevis, M., Schänzer, W., Analytical approaches for the detection of emerging therapeutics and non-approved drugs in human doping controls. Journal of Pharmaceutical and Biomedical Analysis, 2014. 101: p. 66-83. DOI: 10.1016/j.jpba.2014.05.020.
27. Международный Стандарт: Кодекс, Всемирный Антидопинговый. Приложение 1. Запрещенный список. 2020; Available from: https://rusada.ru/upload/iblock/06d/%D0%97%D0%B0%D0%BF%D1%80%D0%B5%D1%89%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9%20%D1%81%D0%BF%D0%B8%D1%81%D0%BE%D0%BA%202020.pdf.
28. Sobolevsky, T., Ahrens, B., Urinary concentrations of AICAR and mannitol in athlete population. Drug Testing and Analysis, 2019. 11(3): p. 530-535. DOI: 10.1002/dta.2557.
29. Kandwal, S., Fayne, D., Repurposing drugs for treatment of SARS-CoV-2 infection: Computational design insights into mechanisms of action. Research Square 2020: p. preprint. DOI: https://doi.org/10.21203/rs.3.rs-54535/v1.