5-Амино-1MQ (5-амино-1-метилхинолиний) – новый перспективный препарат, который ингибирует фермент никотинамид N-метилтрансферазу (NNMT). Повышенные уровни NNMT связаны с многими патологическими состояниями, включая ожирение, мышечную дистрофию и рак. Поэтому NNMT может быть хорошей мишенью для новых лекарств. Действуя на NNMT, 5-амино-1MQ подавляет активность фермента, тем самым устраняя первопричину заболевания. В обзоре рассмотрены результаты доклинических исследований препарата, показавшие его способность снижать вес при ожирении, укреплять мышцы и подавлять рост раковых клеток, а также перспективы применения 5-амино-1MQ в медицине.
Введение
Ожирение – хроническое заболевание, которое вызывает свыше двухсот нарушений функций организма [1]. С 1980-ых годов распространенность ожирения удвоилась в половине стран мира. Большой индекс массы тела (ИМТ более 25 кг/м2) служит причиной более 4 млн смертей по всему миру [2]. Избыточный вес и ожирение трудно поддаются коррекции или эффективному лечению. Это может быть связано с изменениями в метаболизме, которые снижают способность организма расщеплять жировые запасы и превращать их в источник энергии. В результате людям, страдающим от избыточного веса и ожирения, со временем становится труднее сбросить вес, независимо от диеты, стиля питания или режима физической активности. По мере увеличения жировых клеток, они начинают чрезмерно вырабатывать фермент под названием никотинамид N-метилтрансфераза (NNMT). Этот фермент тормозит метаболизм жировых клеток (т. е., сжигание жира). Из-за замедления процессов клеткам становится труднее расщеплять накапливающийся жир. По мере роста жировой ткани и увеличения количества NNMT, вырабатывается большое количество гормонов и провоспалительных сигнальных белков, ответственных за увеличение веса и другие хронические болезни, такие как диабет второго типа и сердечно-сосудистые заболевания.
Исследователи из Техасского университета (The University of Texas Medical Branch at Galveston) обнаружили молекулу, которая блокирует замедление метаболизма в белых жировых клетках, вызванное избытком NNMT. Подавляя процесс замедления метаболизма, ученые смогли увеличить метаболизм в белых жировых клетках и уменьшить размер белых жировых отложений. В результате этого происходит потеря веса, потому что лечится первопричина ожирения и связанных с ней метаболических нарушений.
Команда под руководством доцента Стэнли Ватовича (Stanley Watowich) обнаружила, что один конкретный тип соединений обладает наиболее высокой селективностью в отношении фермента, не оказывая влияния ни на одну другую молекулу, участвующую в метиониновом или никотинамид-аденин-динуклеотидном (NAD+) пути.
Эти лекарства-кандидаты относятся к производным метилхинолиния (MQ). Некоторые из них, включая diMQ, 7-амино-MQ и 2,3-диамино-1MQ, продемонстрировали значительную эффективность в ингибировании NNMT, жизнеспособности клеток и проницаемости мембран в серии тестов in vitro. Однако 5-амино-1MQ не только показал эти способности, но и не влиял на активность каких-либо других ферментов и родственных метилтрансфераз в соответствующих метаболических циклах, тем самым снижая риск потенциальных побочных эффектов. Поэтому 5-амино-1MQ был выбран для использования в последующей серии испытаний in vivo на мышах.
Что такое NNMT?
NNMT расшифровывается никотинамид N-метилтрансфераза. Именно она является ключевой мишенью в перспективной терапии ожирения [3]. Это важный цитозольный фермент, катализирующий перенос метильной группы с кофактора S-(5′-аденозил)-L-метионина (SAM) на субстраты, такие как никотинамид (NCA), пиридин и родственные аналоги (например, хинолин, изохинолин, 1,2,3,4-тетрагидроизохинолин), непосредственно регулируя детоксикацию эндогенных и экзогенных веществ путем образования метилированных продуктов метаболизма (1-метилникотинамид [1-МНА], метилированные пиридины и метилированные аналоги) [4]. NNMT модулирует клеточный энергетический баланс, регулируя уровни никотинамида и S-(5′-аденозил)-L-метионина в рамках внутриклеточных путей, которые участвуют в контроле клеточной энергии.
С возрастом метаболизм человека становится не таким эффективным, как раньше – люди не могут сбросить лишний вес, который накопился со временем. Это вызывает «эффект домино»: одна проблема ведет к следующей. В данном случае избыточный вес может привести к увеличению выработки фермента NNMT, что вызывает несбалансированный метаболизм жировых клеток, который затем ведет к увеличению массы жировых клеток и набору массы тела. Вот почему необходимо изменить активность NNMT для уменьшения веса. Во-первых, снижение активности NNMT означает, что жировые клетки не растут. Во-вторых, таким образом может быть скорректирован метаболизм жировых клеток. И, в-третьих, подавление NNMT ведет к тому, что потеря веса происходит благодаря уменьшению жировых клеток. Таким образом устанавливается связь между блокированием замедления метаболизма и потерей веса.
С учетом основной метаболической функции, NNMT экспрессируется преимущественно в печени, но значительные уровни фермента присутствуют и в других тканях, включая жировую ткань, почки, мозг, легкие, сердце и мышцы [5]. Повышенная экспрессия и ферментативная активность NNMT связана с рядом хронических заболеваний, что делает его значимой и актуальной мишенью для разработки лекарств. Например, несколько исследований продемонстрировали причинно-следственную связь между повышенной экспрессией NNMT и усиленной клеточной пролиферацией/прогрессией в различных линиях раковых клеток, что потенциально позволяет использовать NNMT в качестве прогностического биомаркера рака и мишени для разработки противораковой терапии. Сообщалось также, что экспрессия NNMT повышена у пациентов с болезнью Паркинсона – это, как предполагается, связано с производством нейротоксинов, таких как ионы N-метилпиридиния, которые лежат в основе нейродегенерации. SAM-зависимые метилтрансферазы представляют собой основной класс биотрансформирующих ферментов, которые катализируют метилирование, связанное с выработкой нейротоксинов, таких как ионы N-метилпиридиния, лежащих в основе нейродегенерации. На рисунке 1 показана структура NNMT.
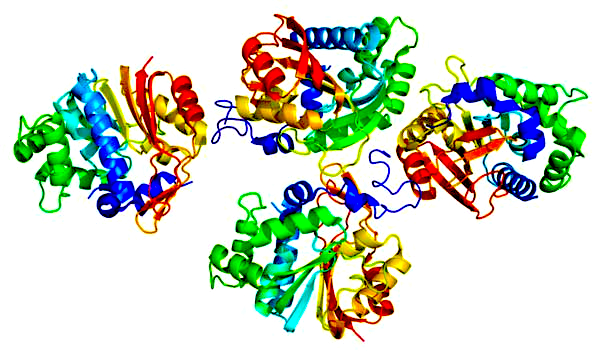
Рисунок 1 – Структура белка NNMT
NNMT вовлечена в остеоартрит, метаболические нарушения, сердечно-сосудистые заболевания, рак, заболевания почек, болезнь Паркинсона и другие нейрососудистые или неврологические дисфункции [6]. Более высокая экспрессия NNMT и концентрация 1-метилникотинамида (MNA) ассоциируются с ожирением и диабетом второго типа [5]. В настоящее время исследователи предпринимают усилия по разработке лекарственных препаратов, направленных на NNMT и вызывающих целенаправленное уменьшение белой жировой ткани, что приводит к значительному снижению веса и улучшению сопутствующих заболеваний, связанных с ожирением. Исследования как на животных, так и на людях показали, что экспрессия и активность NNMT повышена при ожирении и связанных с ним хронических метаболических заболеваниях (например, диабете второго типа) [5, 7]. Сообщалось, что нокдаун экспрессии NNMT с помощью антисмыслового олигонуклеотида подавляет увеличение массы тела, уменьшает жировую массу и увеличивает энергозатраты у мышей, которых кормили диетой с высоким содержанием жира [7]. Хотя молекулярные механизмы, связывающие снижение активности NNMT с увеличением метаболизма адипоцитов, изучены недостаточно хорошо, NNMT может модулировать оборот внутриклеточных метаболитов в метионин-гомо-цистеиновом цикле и/или путь синтеза NAD+, критически важный для регулирования энергозатрат в клетках. Поэтому целевые ингибиторы NNMT в виде малых молекул могут оказаться полезными в качестве молекулярных зондов для механистических исследований и разработки терапевтических средств для лечения метаболических и хронических заболеваний, характеризующихся аномальной активностью NNMT.
Как же блокировать замедление метаболизма (или ингибировать NNMT), чтобы похудеть? Исследователи использовали различные варианты введения заместителей в молекулу метилхинолиния (MQ) для измерения эффективности блокирования NNMT. Из всех изученных вариантов MQ, 5-амино-1MQ оказался наиболее эффективным. 5-Амино-1MQ – это маленькая, селективно проникающая через мембрану молекула, которая блокирует фермент NNMT. Еще более эффективным 5-амино-1MQ делает то, что он не влияет на активность других ферментов в метаболических циклах, поэтому снижается риск любых потенциальных побочных эффектов. 5-Амино-1MQ показал перспективность блокирования NNMT для улучшения метаболизма жировых клеток и снижения веса. 5-Амино-1MQ или другие замещенные MQ могут оказаться полезными для лечения целого ряда заболеваний
5-Амино-1MQ
5-Амино-1-метилхинолиний (5-Amino-1-methylquinolinium, iodide (1:1), 5-Amino-1MQ iodide, 5-Amino-1MQ iodide, JBSNF-000088; C10H11N2·I; CAS 42464-96-0; примечание: 1,89 мг йодистой соли содержит 1 мг экв. 5-Амино-1MQ). Структура показана на рисунке 2.
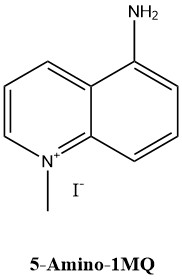
Рисунок 2 – Структура 5-амино-1-метилхинолиний йодида
5-Амино-1MQ является селективным ингибитором никотинамид N-метилтрансферазы [4], направленным на субстратный сайт (IC50=1,2 мкМ; 50 мкМ SAM, 100 мкМ NCA). 5-Амино-1MQ снижает липогенез в клеточной линии 3T3-L1, которую применяют в биологических исследованиях жировой ткани (EC50=30 мкМ), и уровень 1-метилникотинамида в адипоцитах, преимущественно формирующих жировую ткань (EC50=2,3 мкМ), не влияя на связанные метилтрансферазы и ферменты в пути восстановления NAD+. 5-Амино-1MQ демонстрирует терапевтическую эффективность in vivo в мышиных моделях с рационом с высоким содержанием жиров (high fat diet-induced obesity, DIO) (20 мг/кг/сут.) и мышечной травмы (5 или 10 мг/кг/сут.) без побочных эффектов для животных (до 60 мг/кг/сут.).
5-Амино-1MQ – синтетический препарат, который получают кватернизацией 5-аминохинолина под действием йодистого метила в изопропаноле при нагревании [8]. Другие замещенные хинолины тоже проявляют ингибирование NNMT, а выбор заместителей позволяет тонко настраивать активность целевого соединения [8].
5-Амино-1MQ и потеря веса
Ингибирование NNMT увеличивает внутриклеточные концентрации NAD+ и SAM в дифференцированных адипоцитах [7]. Поскольку исследования in vitro показали, что 5-амино-1MQ обладает высокой клеточной проницаемостью, селективностью и эффективностью в культуре клеток, было проведено субхроническое (11 дней) исследование in vivo для проверки влияния ингибирования NNMT на ожирение у мышей, питающихся высокожировой диетой (HFD). Эксперимент был проведен на 17-недельных самцах мышей DIO, которых, начиная с шестой недели, кормили диетой HFD в течение 11 недель. Мышей рандомизировали в сбалансированные контрольную и лечебную когорты (n=9/когорта), с одинаковой средней массой тела. Мыши в контрольной когорте получали подкожнопо три инъекции физраствора (1 мл/кг) в день, а мышам в экспериментальной когорте вводили три инъекции ингибитора NNMT – 5-амино-1MQ – в дозе по 20 мг/кг(общая доза 34 мг/кг/день в пересчете на свободное соединение) в течение 11 дней. Выбранная дозировка была основана на предварительном исследовании по увеличению дозы (от 10 мг/кг/день до общей дозы 150 мг/кг/день на мышах DIO (n=2). Суммарная доза 60 мг/кг/день хорошо переносилась животными без заметных побочных эффектов. Вес тела и потребление пищи измеряли каждые два дня. На 12-ый день мышей подвергали четырехчасовому голоданию, затем наркотизировали, собирали кровь и вырезали эпидидимальную белую жировая ткань (EWAT).
Трехкратное ежедневное системное лечение мышей DIO 20 мг/кг 5-амино-1MQ приводило к прогрессирующему снижению массы тела в течение периода лечения по сравнению с контролем [7]. Двухсторонний анализ ANOVA с повторными измерениями выявил значительный основной эффект фактора леченияи времени. Последующие тесты множественного сравнения Сидака обнаружили значимые различия в массе тела между контрольными и обработанными DIO мышами на 6, 9и 11дни. В конце 11-дневного периода лечения контрольные мыши DIO показали суммарное увеличение веса на 0,6±0,4 г (~1,4% увеличения веса по сравнению с исходными показателями), в то время как животные DIO, получавшие ингибитор NNMT, снизили массу тела на 2,0±0,6 г (~5,1% потери веса по сравнению с начальным уровнем). Потребление пищи оставалось одинаковым между группами, что указывает связь эффекта потери веса в первую очередь с изменением метаболизма (т. е., увеличением затрат энергии). Общеесуммарное потребление пищи у контрольных и обработанных мышей DIO составило 28,1±1,2 г и 26,2±1,4 г, соответственно. Кроме того, лечение мышей ингибитором NNMT привело к значительному снижению массыи размераEWAT – на ~35%по сравнению с контролем. В соответствии с этими результатами, гистологический анализ EWAT от обработанных мышей DIO показал >30% уменьшение размера и >40% снижение объема адипоцитов,по сравнению с контрольными мышами DIO. Измерения липидного профиля плазмы показали, что уровень общего холестерина был на >30% ниже у обработанных мышей DIO против контрольной когорты. Уровень общего холестерина в конце исследования у контрольных мышей DIO был сопоставим с обычным для соответствующих по возрасту особей. Напротив, уровень холестерина у мышей DIO, обработанных ингибитором NNMT, был сходен с таковым, характерным для мышейс нормальным питанием [7].
Ингибирование NNMT подавляет липогенез (образование жировой ткани) в клетках 3T3-L1 [7]. Чтобы определить влияние ингибирования NNMT на дифференцировку адипоцитов и липогенез, авторы измерили накопление липидов в адипоцитах после обработки клеток 3T3-L1 с помощью 5-амино-1MQ в среде, содержащей адипогенные факторы. В результате было обнаружено концентрационно-зависимое ингибирование накопления липидов в дифференцирующихся преадипоцитах. Концентрации 30 мкМ и 60 мкМ 5-амино-1MQ снижали липогенез на 50% и 70%, соответственно, по сравнению с контрольными необработанными адипоцитами. Жизнеспособность клеток 3T3-L1 была лишь незначительно снижена при самой высокой концентрации 5-амино-1MQ.
Комбинированное ингибирование никотинамид-N-метилтрансферазы и диета с пониженным содержанием калорий нормализует состав тела и создает метаболические преимущества у мышей с ожирением [9]. В условиях эксперимента самцы мышей 18-недельного возраста с ожирением, вызванным диетой (DIO), и тощие контрольные мыши (DIO контроль) во время исследованийполучали одну из двух диет: 60% высокожировая диета (HFD; 60 ккал% жира, формула OpenSource Diets D12492), западная диета (WD; 45 ккал% жира, формула OpenSource Diets D12451) или низкожировая диета (LD; 10 ккал% жира, формула OpenSource Diets D12450B). Двадцать две 18-недельные мыши DIO были переведены с HFD на WD после нахождения на WD в течение четырех недель. Затем животные были рандомизированы в три группы, сбалансированные по средней исходной массе тела и составу, с двумя контрольными группами, получавшими физраствор в дозе 10 мкл на грамм массы тела (n=6–8), и одной экспериментальной группой, получавшей 5-амино-1MQ с концентрацией 4 мг/мл, по 10 мкл на грамм массы тела (n=8). Восемь тощих контрольных мышей содержались на LD в течение всего исследования и получали аналогичное количество физраствора. Группа, получавшая терапию ингибитором NNMT, и одна из групп WD, получавших физраствор, были переведены на LD за пять дней до начала лечения. Через три дня после перехода этих двух групп на LD диету всем мышам делали ежедневные мнимые инъекции физраствора в течение двух дней для привыкания к манипуляциям. Измерения массы тела и потребление пищи проводились два раза в неделю, а также один раз в неделю велось сканирование состава всего организма мышей. Объемы инъекций корректировались дважды в неделю в соответствии с последним зарегистрированным весом тела каждого животного.
Двадцатидвухнедельные мыши с ожирением, ранее содержавшиеся на высокожировой «западной» диете (WD) были переведены на LD, акклиматизированы в течение трех дней, а затем рандомизированы на контрольные группы с физраствором (WD/LD-V) и 5-амино-1MQ (WD/LD-T), наряду с контрольными группами с LD и WD [9]. Снижение потребления калорий при переходе на LD привело к первоначальной потере массы тела, в среднем 4,3 г к 20-му дню, которая вышла на плато с небольшим последующим восстановлением веса у мышей WD/LD-V (кумулятивная потеря массы тела в среднем составила 2,9 г к 45-му дню). Изменения массы тела в группе WD/LD-V сопровождались снижением жировой массы в течение первых 3,5 недель после перехода на LD, а затем – непрерывным восстановлением жировой массы до конца исследования (общая потеря жировой массы в группе WD/LD-V составила 0,55 г). Напротив, у мышей WD/LD-T наблюдалась ускоренная потеря массы тела и жира, которая сохранялась на протяжении всего исследования (кумулятивная потеря массы тела 6,3 г в конце исследования), что статистически значимо отличалось от перехода только на LD и было практически неотличимо от группы LD/LD-V по уровню общей и жировой массы тела. Процентное изменение жировой массы по сравнению с исходным уровнем было в десять раз выше при лечении с помощью 5-амино-1MQ (~29,3% потери жировой массы) по сравнению с группой LD (2,9% потери жировой массы), а потеря массы тела, измеренная в процентах от исходного уровня, была более чем в два раза выше при введении 5-амино-1MQ по сравнению с группой LD. У контрольных мышей LD/LD-V наблюдался сдвиг в сторону увеличения жировой массы, т. е. среднее чистое увеличение жировой массы всего тела на 2,4 г, несмотря на относительную стабильность веса на протяжении семи недель (кумулятивное увеличение массы тела – 1,4 г). Отчасти это объясняется длительным содержанием на LD, имеющем значительно более высокий углеводный состав. Напротив, мыши WD/WD-V демонстрировали классический фенотип ожирения, с постоянным увеличением массы тела (кумулятивный прирост массы тела 6,0 г) и жировой массы – масса жира во всем теле была почти в три раза выше, чем у контрольных мышей LD/LD-V в конце исследования. Изменение чистой жировой массы во всех экспериментальных группах положительно коррелировало с изменением чистой массы тела), что свидетельствует о тесной взаимосвязи между этими показателями и их чувствительностью к диете и/или экспериментальному вмешательству. Лечение при помощи 5-амино-1MQ в сочетании со сниженной калорийностью рациона привело к значительному, стойкому и кумулятивному увеличению отношения сухой массы всего тела к общей массе тела по сравнению с исходным уровнем, что значительно отличалось от показателей контрольных групп.
Среднесуточное потребление пищи существенно не различалось по группам, но отличалось в зависимости от недели исследования,особенно в экспериментальной когорте [9]. У мышей, переведенных с WD на LD, наблюдалось значительное снижение среднесуточного потребления пищи в течение первой недели после смены диеты по сравнению с мышами WD/WD-V, но это снижение исчезло после второй недели.
Содержание жира в печени значительно отличалось между группами лечения [9]. Примечательно, что уровень жировой ткани в средней доле печени при переходе только на постную диету не отличался от показателей у мышей WD/WD-V с ожирением. Напротив, уровень жировой ткани печени и соотношение жира к весу в средней доле в группе с комбинированным переходом на LD/NNMTi (WD/LD-T) был значительно ниже, чем у мышей с ожирением WD/WD-V и группы WD/LD-V с переходом только на LD (снижение более чем на 45%), и сопоставим с контрольной группой LD/LD-V. Аналогичные различия наблюдались между группами при анализе общего веса всей печени, хотя при нормализации веса всей печени к весу тела общий эффект группы лечения терялся. Важно отметить, что относительное содержание печеночного жира в средней доле печени мышей WD/LD-T было идентичным по сравнению с контрольными мышами LD/LD-V, тогда как у мышей WD/LD-V оно было идентичным мышам WD/WD-V, страдающими ожирением. Лечение ингибитором NNMT в сочетании с диетой с пониженным содержанием калорий (LD)оставилоуникальную метаболомную подпись в жировой ткани, с преобладающим увеличением количества кетогенных аминокислот и изменениями метаболитов, связанных с путями энергетического метаболизма. В целом, полученные данные свидетельствуют о том, что такая терапия может вести к обширным восстановительным изменениям жировой ткании печени мышей, ранее страдавших ожирением. Эти резервуары соответствуют потере >10% жира во всем теле. В противоположность этому, сама по себе диета с ограничением калорий недостаточна для снижения уровня жировой ткани в EWAT и печени мышей, страдавших ожирением, что говорит о трудности обращения вспятьпатогенного накопления жировой ткани, развившегося при вызванном диетой ожирении.
5-Амино-1MQ, клетки мышц и старение
Известны доказательства того, что повышенная экспрессия NNMT является общим признаком мышечного истощения при мышечной дистрофии Дюшенна, и что снижение уровня NNMT может облегчить симптомы некоторых дистрофических заболеваний [10]. Это связано со способностью NNMT подавлять рост и деление стволовых клеток. Понижая активность NNMT, 5-амино-1-MQ и родственные соединения могут принести пользу при различных заболеваниях, связанных с истощением мышц.
Старение сопровождается прогрессирующим снижением массы и силы скелетных мышц и нарушением способности к регенерации, что предрасполагает пожилых людей к изнурительному возрастному ухудшению качества мышц. Мышечные стволовые клетки (muSC) пролиферируют и дифференцируются в миобласты, которые способствуют регенерации мышц. Однако при старении muSC становятся все менее функциональными, ухудшая восстановление мышц после травм. Регуляторы активности muSC могут предложить новые терапевтические средства для улучшения восстановления и снижения заболеваемости среди пожилых людей, однако имеющихся терапевтических средств для восстановления muSC не существует.
Исследователи предположили, что лечение ингибитором NNMT (5-амино-1-MQ) устранит возрастной дефицит активности muSC и будет способствовать регенерации после травмы в стареющих мышцах [11]. Пожилых 24-месячных мышей лечили физраствором (контроль), низкой и высокой дозой 5-амино-1-MQ (5 мг/кг; n=10 и 10 мг/кг; n=13, соответственно). Мыши получали дважды в день подкожные инъекции в течение двух недель (одна неделя до травмы и одна неделя после травмы). Острую мышечную травму вызывали инъекцией хлорида бария в переднюю большеберцовую мышцу. Все группы мышей продолжали получать двухразовые инъекции физраствора или 5-амино-1-MQ с 8 по 14 день. Отдельная когорта пожилых мышей была рандомизирована в контрольную (физраствор; n=6) и высокодозную группу лечения 5-амино-1-MQ (10 мг/кг; n=6). В отличие от краткосрочной схемы лечения, мыши получали дважды в день подкожные инъекции физраствора или 5-амино-1-MQ в течение четырех недель; предварительное лечение в течение 7 дней до травмы, а затем три недели после.Мышей взвешивали и регистрировали массу тела каждые два дня. Пища и вода были доступны ad libitum. Дляанализа активности muSC вводили 5-этинил-2′-дезоксиуридин. Затем in vivo проводились измерения сократительной функции поврежденной мышцы и сбор тканей для анализа ex vivo и оценки восстановления мышцы.
Результаты показали, что пролиферация и последующее слияние мышечных стволовых клеток были повышены у мышей, получавших 5-амино-1-MQ, что подтверждает почти двукратное увеличение площади поперечного сечения миофибры и изменения в распределении размеров волокон в сторону увеличения их доли большего размерапо сравнению с контролем [11]. Длительное применение 5-амино-1-MQ после травмы еще больше усилило регенерацию миофибр. Важно отметить, что улучшение активности muSC привело не только к увеличению размеров миофибры после травмы, но и к восстановлению сократительной функции: пиковый крутящий момент увеличился на ∼70% у мышей, которым вводили 5-амино-1-MQ, по сравнению с контролем. Аналогичные результаты были воспроизведены in vitro с миобластами C2C12, где 5-амино-1-MQ способствовал усилению дифференцировки миобластов с соответствующими изменениями в клеточном окислительно-восстановительном состоянии NAD+/NADH. В целом, эти результаты подтверждают, что ингибиторы NNMT предоставляют перспективный фармакологический подход к усилению регенерации старых мышц путем восстановления функции muSCпосле травм опорно-двигательного аппарата у пожилых людей
5-Амино-1MQ и рак
Сверхэкспрессия никотинамид-N-метилтрансферазы может быть связана с плохим [I1] прогнозом при раке яичников, а также с другими онкологическими патологиями [12]. NNMT ассоциируется с прогрессированием и метастазированием опухоли. Предварительные эксперименты на эпителиальной линии клеток рака шейки матки HeLa показали in vitro, что 0,1–500 мкМ 5-амино-1-MQ подавляют раковые клетки [13]. Жизнеспособность клеток оценивали с помощью МТТ-теста. Уровни экспрессии мРНК и различных белков анализировали с помощью количественной полимеразной цепной реакции в реальном времени (qRT-PCR) и вестерн-блоттинга. 5-Амино-1-MQ значительно ингибировал пролиферацию клеток HeLa в зависимости от концентрации и времени. После обработки 5-амино-1-MQ в культуре HeLa наблюдалось повышенная гибель клеток, потеря клеточной адгезии и возрастание количества апоптотических тел. После обработки 5-амино-1-MQ уровни мРНК ZEB1, SIRT1, CD16 увеличились, а мРНК TWIST и SERPIN1 – уменьшились. Экспрессия онкогенных белков phospho-Akt и SIRT1 снизилась. 5-Амино-1-MQ может эффективно ингибировать пролиферацию клеток HeLa, не оказывая очевидного влияния на пролиферацию клеток HEK-293
5-Амино-1MQ и возможность использования человеком
5-Амино-1MQ не исследован на людях, однако доступен в интернет-магазинах как пищевая добавка. Такие продукты не являются лекарственными препаратами и не были одобрены FDA для профилактики или лечениякакого-либо состояния, недомогания или болезни. По неизвестным причинам, многие продавцы ошибочно маркируют 5-амино-1MQ как пептид, вероятно, в рекламных целях. Прием 5-амино-1MQ в сочетании с низкокалорийной или кетогенной диетой со временем может привести к увеличению сжигания и расхода жира в организме. Продавцы рекомендуют принимать 5-амино-1MQв течение 2–3 месяцев, один раз в день утром.Коммерчески доступныкапсулы, содержащиепо 1, 5 и 50 мг, но часто дозировкане указана. Суточное потребление 5-амино-1MQ находится в диапазоне 50–150 мг в день.
Неофициальные потребители5-амино-1MQ сообщают, что препарат может улучшать самочувствие, снижатьболи в теле, вызывать прилив энергии и повышать концентрацию внимания. Некоторые из них через 2–3 недели отмечали заметную потерю жира при ежедневном приеме по 150 мг препарата.
О побочных эффектах 5-амино-1MQ у человека не сообщалось, однако научных данных о безопасности длительного применения или максимально допустимой дозировке данного вещества не известно.
Заключение
В заключение следует отметить, что современные исследования свидетельствуют в пользу ингибиторов NNMT как терапевтического подхода для лечения ожирения, вызванного диетой, и сопутствующих метаболических заболеваний. Новый способ может дать надежду пациентам с тяжелой формой ожирения.
Эксперименты на мышах по применению 5-амино-1MQ в сочетании с диетой с пониженным содержанием калорий продемонстрировали быструю, значительную и устойчивую потерю массы тела и жира, а также облегчение сопутствующих патологий печени у животных с ожирением.
В целом, модуляция массы тела, жировой массы, физиологии печени и метаболома жировой ткани с помощью5-амино-1MQ убедительно подтверждает его перспективность в качестве терапевтического средства для лечения ожирения и сопутствующих заболеваний. Кроме того, 5-амино-1MQ демонстрирует благоприятные характеристики, подходящие для лекарственных средств, включая высокую растворимость в воде, пассивную проницаемость и активный транспорт, поражение мишеней in vitro (например, адипоцитов) и in vivo (мышиной жировой ткани), межвидовую метаболическую стабильность печени, а также длительнуюсистемную экспозицию и фармакокинетический профиль.
Снижение уровня NNMT под действием5-амино-1MQ может принести пользу при различных заболеваниях, связанных с истощением мышц. Препарат показал противоопухолевые эффекты in vitro.
Преимуществами 5-амино-1MQ являютсявозможность обращения вспять вызванного диетой ожирения илечение связанных с ним метаболических состояний.Может увеличить клеточные регуляторы энергии. 5-Амино-1MQ способен предотвращать липогенез (накопление жира),увеличивать концентрацию NAD+ и SAM в жировых клетках и регулировать затраты энергии. 5-Амино-1MQ нуждается в проведении клинических исследований на здоровых людях и пациентах.
Лоркасерин: снижение аппетита и лечение ожирения
Тезофензин для снижения веса
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
1. Tremmel, M., Gerdtham, U.-G., Nilsson, P.M., Saha, S. Economic Burden of Obesity: A Systematic Literature Review. Int J Environ Res Public Health, 2017. 14,DOI: 10.3390/ijerph14040435.
2. Collaborators’, G.B.D.O., Health effects of overweight and obesity in 195 countries over 25 years. New England Journal of Medicine, 2017. 377(1): p. 13-27.
3. Liu, J.-R., Deng, Z.-H., Zhu, X.-J., Zeng, Y.-R., Guan, X.-X., Li, J.-H., Roles of Nicotinamide N-Methyltransferase in Obesity and Type 2 Diabetes. Biomed Res Int, 2021. 2021. DOI: https://doi.org/10.1155/2021/9924314.
4. Watowich, S.J., Discovery of Novel N-Nicotinamide Methyltransferase Inhibitors to Combat Obesity-Linked Osteoarthritis and Metabolic Disease Among Veterans and Beneficiaries. 2018, University of Texas Medical Branch at Galveston Galveston United States.
5. Kannt, A., Rajagopal, S., Kadnur, S.V., Suresh, J., Bhamidipati, R.K., Swaminathan, S., Hallur, M.S., Kristam, R., Elvert, R., Czech, J., Pfenninger, A., Rudolph, C., Schreuder, H., Chandrasekar, D.V., Mane, V.S., Birudukota, S., Shaik, S., Zope, B.R., Burri, R.R., Anand, N.N., Thakur, M.K., Singh, M., Parveen, R., Kandan, S., Mullangi, R., Yura, T., Gosu, R., Ruf, S., Dhakshinamoorthy, S., A small molecule inhibitor of Nicotinamide N-methyltransferase for the treatment of metabolic disorders. Scientific Reports, 2018. 8(1): p. 3660. DOI: 10.1038/s41598-018-22081-7.
6. Neelakantan, H., Vance, V., Wang, H.-Y.L., McHardy, S.F., Watowich, S.J., Noncoupled Fluorescent Assay for Direct Real-Time Monitoring of Nicotinamide N-Methyltransferase Activity. Biochemistry, 2017. 56(6): p. 824-832. DOI: 10.1021/acs.biochem.6b01215.
7. Neelakantan, H., Vance, V., Wetzel, M.D., Wang, H.-Y.L., McHardy, S.F., Finnerty, C.C., Hommel, J.D., Watowich, S.J., Selective and membrane-permeable small molecule inhibitors of nicotinamide N-methyltransferase reverse high fat diet-induced obesity in mice. Biochemical Pharmacology, 2018. 147: p. 141-152. DOI: https://doi.org/10.1016/j.bcp.2017.11.007.
8. Neelakantan, H., Wang, H.-Y., Vance, V., Hommel, J.D., McHardy, S.F., Watowich, S.J., Structure–Activity Relationship for Small Molecule Inhibitors of Nicotinamide N-Methyltransferase. Journal of Medicinal Chemistry, 2017. 60(12): p. 5015-5028. DOI: 10.1021/acs.jmedchem.7b00389.
9. Sampson, C.M., Dimet, A.L., Neelakantan, H., Ogunseye, K.O., Stevenson, H.L., Hommel, J.D., Watowich, S.J., Combined nicotinamide N-methyltransferase inhibition and reduced-calorie diet normalizes body composition and enhances metabolic benefits in obese mice. Scientific Reports, 2021. 11(1): p. 5637. DOI: 10.1038/s41598-021-85051-6.
10. Pissios, P., Nicotinamide N-Methyltransferase: More Than a Vitamin B3 Clearance Enzyme. Trends in Endocrinology & Metabolism, 2017. 28(5): p. 340-353. DOI: https://doi.org/10.1016/j.tem.2017.02.004.
11. Neelakantan, H., Brightwell, C.R., Graber, T.G., Maroto, R., Wang, H.-Y.L., McHardy, S.F., Papaconstantinou, J., Fry, C.S., Watowich, S.J., Small molecule nicotinamide N-methyltransferase inhibitor activates senescent muscle stem cells and improves regenerative capacity of aged skeletal muscle. Biochemical Pharmacology, 2019. 163: p. 481-492. DOI: https://doi.org/10.1016/j.bcp.2019.02.008.
12. Harmankaya, İ., Akar, S., Uğraş, S., Güler, A.H., Ezveci, H., Aydoğdu, M., Çelik, Ç., Nicotinamide N-methyltransferase overexpression may be associated with poor prognosis in ovarian cancer. Journal of Obstetrics and Gynaecology, 2021. 41(2): p. 248-253. DOI: 10.1080/01443615.2020.1732891.
13. Akar, S., Duran, T., Azzawri, A.A., Koçak, N., Çelik, Ç., Yıldırım, H.İ., Small molecule inhibitor of nicotinamide N-methyltransferase shows anti-proliferative activity in HeLa cells. Journal of Obstetrics and Gynaecology, 2021: p. 1-9. DOI: 10.1080/01443615.2020.1854696.
[I1]Полный текст не доступен, поэтому численных изменений привести не получается.