Ожирение и сопутствующие заболевания – серьезная медицинская проблема. Препарат лоркасерин помогает в снижение массы тела, подавлении расстройств пищевого поведения и потенциально полезен для борьбы с неподдающимися лечению эпилептическими судорогами, никотиновой зависимостью и злоупотреблением различными наркотическими веществами. Существуют подозрения, что лоркасерин может повышать риск развития онкологических заболеваний легких и поджелудочной железы. В обзоре рассмотрены результаты доклинических и клинических испытаний препарата, а также вопросы безопасности его применения.
Ожирение
Ожирение – это хроническое, сложное, неоднородное заболевание, которое может вызывать более 200 других нарушений здоровья, затрагивающих целые системы органов [1]. С 1980 года показатели ожирения удвоились в 73 странах, при этом высокий индекс массы тела (ИМТ >25 кг/м2) является причиной ~4 млн смертей во всем мире [2]. Быстрый рост распространенности ожирения в сочетании с его разрушительными последствиями для здоровья и сопутствующими заболеваниями подчеркивает необходимость раннего распознавания и соответствующего лечения.
Ранее ожирение рассматривалось исключительно как результат образа жизни или поведения, однако в настоящее время видна сложная физиология этого заболевания и его разрушительное влияние на качество жизни. Также известно, что эпидемия обусловлена изменениями в современной микро- и макросреде, а эпигенетические, генетические, импринтинговые и ранние события жизни влияют на индивидуальную предрасположенность к набору веса и накоплению жировой ткани. Факторы окружающей среды и образа жизни – циркадный ритм, вкусовые предпочтения и доступность продуктов, социальные привычки и ресурсы – также подают сигналы в «эмоциональный или когнитивный мозг» и центральные пути «метаболического мозга». Эти пути получают гуморальные, метаболические и нейронные сигналы от желудочно-кишечного тракта, мышечной системы и жировой ткани, становясь важнейшими интегральными компонентами энергетического гомеостаза.
В настоящее время существует пять основных препаратов против ожирения, одобренных FDA: фентермин, орлистат, фентермин/топирамат пролонгированного высвобождения (ER), налтрексон пролонгированного высвобождения (SR)/бупропион, SR и лираглутид, который является единственным инъекционным препаратом. Большинство этих препаратов действуют на ЦНС, снижая аппетит или усиливая чувство сытости, за исключением орлистата, который уменьшает всасывание жиров. Далее рассматривается еще одно лекарственное средство от ожирения – лоркасерин.
Лоркасерин, основные характеристики
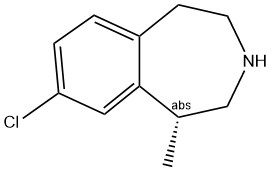
Лоркасерин (Lorcaserin, Belviq, Lorqess, Белвик, APD-356; (1R)-1-метил-8-хлор-2,3,4,5-тетрагидро-1H-3-бензазепин; CAS 616202-92-7)
Лоркасерин – бензодиазепиновый агонист рецептора 5-гидрокситриптамина 2C (5-HT2C), который действует на анорексигенные нейроны в гипоталамусе, отвечающие за чувство голода. Препарат разработан в начале 2000-ых годов компанией Arena Pharmaceuticals, Inc. (США) [3, 4]. Лоркасерин был частично одобрен FDA в 2009 году и полностью – в 2012 году в качестве дополнения к диете с пониженным содержанием калорий и повышенной физической активности для долгосрочного контроля веса у взрослых с ИМТ ≥30 кг/м2 или ИМТ ≥27 кг/м2, имеющих по крайней мере одно сопутствующее заболевание, связанное с весом, включая сахарный диабет, гипертонию, гиперлипидемию или апноэ сна [5]. С 2013 года препарат начал продаваться в США под торговым названием Belviq®. Лоркасерин также был одобрен в других странах: Южная Корея, Бразилия, Тайвань, Израиль и Мексика, но одобрение не получено на других крупных рынках – в ЕС и Японии [6]. В 2016 году Управление по контролю за продуктами и лекарствами США (FDA) одобрило препарат лоркасерина с пролонгированным высвобождением в качестве дополнения к диете с пониженным содержанием калорий и повышенной физической активности для долгосрочного контроля веса у взрослых, относящихся к категории людей с избыточным весом (ИМТ>27 кг/м2 плюс сопутствующее ожирение) и ожирением (ИМТ>30 кг/м2). В 2017 году компания Eisai стала отвечать за всю деятельность, связанную с глобальной разработкой и подачей регуляторных заявок, а также маркетингом лоркасерина (Belviq®). Из-за целого ряда факторов, включая скромную эффективность, продажи лоркасерина были признаны неудовлетворительными.
Серотонин – важный нейромедиатор, который модулирует потребление пищи и аппетит. Интерес к открытию селективных агонистов рецепторов 5-HT2C в значительной степени был вызван клинической эффективностью серотонинергического препарата широкого действия – ингибитора высвобождения/повторного захвата серотонина (декс)фенфлурамина. Серотонин проявляет свои физиологические эффекты по меньшей мере через 14 различных подтипов рецепторов. Подсемейство 5-HT2 включает три подтипа – 5-HT2A, 5-HT2B и 5-HT2C, все из которых имеют последовательную гомологию более 80% в трансмембранных областях и активируют общие сигнальные пути. Человеческие 5-HT2C рецепторы экспрессируются преимущественно в ЦНС, ими богаты области в хороидном сплетении, префронтальной коре, гиппокампе, базальных ганглиях и других областях мозга, связанных с контролем настроения, мышления и аппетита. Таким образом, рецепторы 5-HT2C рассматриваются в качестве терапевтической мишени для лечения расстройств ЦНС, включая эпилепсию, обсессивно-компульсивное расстройство, болезнь Паркинсона, шизофрению, депрессию и тревогу, нарушения сна и наркоманию. Открытие селективных агонистов рецепторов 5-HT2C может привести к разработке эффективных препаратов против ожирения без побочных эффектов, характерных для неселективных серотонинергических модуляторов. Лоркасерин обладает специфической селективностью к рецептору 5-HT2C, что снижает риски, характерные для фенфлурамина, который имеет сродство к рецепторам 5-HT2A (вызывая галлюцинации) и 5-HT2B (вызывая недостаточность сердечного клапана и легочную гипертензию) [7].
Доклинические испытания
Впервые полная характеристика лоркасерина была описана в работах [7, 8]. Используя клетки HEK-293, экспрессирующие h5-HT2A, h5-HT2B или h5-HT2C было показано, что лоркасерин – ортостерический агонист h5HT2 рецепторов с pEC50 6,8, 6,0 и 8,0 на рецепторах h5-HT2A, h5-HT2B и h5-HT2C соответственно, что дает приблизительно 16- и 80-кратную функциональную селективность для h5-HT2C по отношению к рецепторам h5-HTA и h5-HT2B. На основании внутриклеточного накопления препарата, вызванного сверхмаксимальной концентрацией (10 мкM) 5-HT в идентичных условиях анализа, лоркасерин охарактеризован как полный агонист на рецепторах h5-HT2C и h5-HT2B и частичный агонист h5-HT2A. Также было показано, что лоркасерин обладает агонистической активностью в отношении 5-HT2C, 5-HT2B и 5-HT2A рецепторов крыс и обезьян.
Исследования подтвердили, что лоркасерин оказывает минимальное влияние или вообще не влияет на повторный захват или высвобождение моноаминов в фармакологически активных дозах. Для сравнения, EC50 лоркасерина для индуцирования высвобождения 5-HT (EC50 49000 нМ) в 100 раз выше, чем у фенфлурамина (470 нМ), измеренного в тех же условиях анализа.
Все агонисты рецепторов 5-HT2C вызывают гиполокомоцию (подавляют двигательную активность). Лоркасерин снижает локомоторную активность у крыс и мышей. На вынужденную двигательную активность, лоркасерин также влияет, но только в количествах, которые примерно в 3–10 раз превышают дозы, действующие на спонтанную локомоцию. Это говорит о том, что в низких дозах лоркасерин снижает стремление к исследованию, а не просто ухудшает двигательную активность [9].
Активация рецепторов 5HT2A лоркасерином может происходить при более высоких дозах, 0,3–1 мг/кг [10], но лишь при блокаде рецепторов 5-HT2C. Экстраполяция этих результатов и уровней лоркасерина в плазме и спинномозговой жидкости (ССЖ) в диапазоне доз 0,3–6 мг/кг предпологает более чем десятикратную функциональную селективность 5-HT2C по сравнению с 5-HT2A у крыс. В диапазоне 3–6 мг/кг лоркасерин также вызывал поведение, сходное с недомоганиями, вызываемым противорвотными средствами: необусловленное жевание, расплюснутая поза, слюноотделение и зевание. Это согласуется с тем, что тошнота – частый побочный эффект лоркасерина, отмеченный в клинических испытаниях.
Влияние на питание, ожирение и диабет 2 типа
В ряде экспериментов было изучено влияние лоркасерина на потребление пищи. В тестах на острое питание лоркасерин снижает потребление пищи у крыс [7-9, 11, 12]), мышей дикого типа [13] и низших приматов [14]. В некоторых из исследований эффекты лоркасерина блокировались антагонистами рецепторов 5-HT2C или отсутствовали у мышей с нокаутом гена 5-HT2C. Это подтверждает, что лоркасерин подавляет пищевое поведение через 5-HT2C рецепторы.
Влияние лоркасерина на массу тела было изучено на нескольких моделях ожирения. В отличие от острого питания, когда потребление пищи измеряется в течение короткого периода времени, 1–2 часа, оценка влияния на увеличение массы тела требует длительного воздействия препарата. Это объясняет, почему в двух исследованиях использовались относительно высокие дозы лоркасерина (9–36 мг/кг в сутки [8] и 4,5–18 мг/кг в сутки [7]), где было обнаружено дозозависимое снижение прироста массы тела. В работе [7] также сообщалось о селективном эффекте лоркасерина на снижение жировой массы по отношению к безжировой. Прирост массы тела за 28 дней был снижен примерно на 12% в группах с высокой дозой по сравнению с контрольной группой, получавшей пустышку (плацебо: +15%, препарат 9–18 мг/кг дважды в день: +3%; [7]). В обоих исследованиях в течение 28-дневного периода наблюдалось устойчивое снижение прироста массы тела. Однако эффект лоркасерина был наиболее очевиден на 1–2 день лечения и в дальнейшем неуклонно снижался, так что на 7–14 день потребление пищи в группах стало одинаковым [7, 8]. Таким образом, влияние на потребление пищи и увеличение массы тела было раздельным. После прекращения курса лоркасерина наблюдалось увеличение ежедневного потребления пищи, что привело к восстановлению массы тела, измеренной в течение последующего 28-дневного периода [7].
Отчетливое влияние лоркасерина на уровень глюкозы в крови и другие биомаркеры, связанные с ожирением и диабетом 2 типа, было описано в работе [15]. В модели диабета мышей кормили пищей с высоким содержанием жира в течение трех месяцев. Затем животным вводили однократно физраствор или лоркасерин (2,5–10 мг/кг внутривенно) перед тестом на толерантность к глюкозе. Лоркасерин в дозе 5–10 мг/кг значительно улучшил толерантность к глюкозе (на 50% при дозе 10 мг/кг относительно контроля через 30 минут) и чувствительность к инсулину (на ~40%). Эти данные подтверждают, что лоркасерин значительно улучшает гликемический контроль, по крайней мере, в мышиной модели диабета 2 типа [15].
В целом, исследования показывают, что лоркасерин, как и другие агонисты 5-HT2C рецепторов, может влиять на питание, задействуя три отдельных механизма, т. е., способствуя насыщению, снижая мотивационную ценность пищи и улучшая контроль над импульсивными действиями.
Антинаркотические эффекты
Помимо влияния на потребление пищи и пищевое поведение, агонисты рецепторов 5-HT2C уменьшают потребление наркотиков и поведение, связанное с их поиском. По меньшей мере в двадцати доклинических исследованиях было описано антинаркотическое влияние лоркасерина. Большая часть этих работ подробно рассмотрена в обзорах [16-18]. Из них можно сделать несколько общих выводов:
- Все исследования, изучающие эффект острого или субхронического лечения на грызунах и низших приматах, показывают, что лоркасерин снижает самовведение наркотиков независимо от вида. В большинстве случаев действие лоркасерина является дозозависимым и блокируется антагонистом рецепторов 5-HT2C. Диапазон эффективных доз лоркасерина, снижающий самовведение наркотика у крыс, – 0,3–1 мг/кг.
- Как и другие агонисты рецепторов 5-HT2C, лоркасерин с одинаковой силой снижает самовведение никотина, алкоголя, психостимуляторов (кокаина, метамфетамина, метилендиоксипировалерона (MDPV)) и опиатов (оксикодона, ремифентанила, героина).
- Лоркасерин эффективен в снижении вероятности рецидива угасшего самовведения наркотика. В работе [9], показали, что лоркасерин (0,3–0,6 мг/кг подкожно) притуплял восстановление стремления к никотину. Аналогичные результаты получены с опиатами у крыс и приматов.
- Чрезмерные импульсивные и компульсивные действия являются характерной чертой злоупотребления психоактивными веществами, а также некоторых расстройств пищевого поведения. То, что лоркасерин и агонисты 5-HT2C в целом высокоэффективны в подавлении импульсивных и компульсивных действий, может препятствовать приему и поиску наркотиков.
- В некоторых исследованиях обнаружено, что лоркасерин одинаково снижает реакцию на кокаин и пищу у приматов, которым предоставляется выбор между этими подкреплениями [14]. Полагают, что лоркасерин притупляет обработку вознаграждения, что может частично объяснить, почему снижается реакция на эти подкрепления.
Экспериментальные модели судорог
Синдром Драве и синдром Леннокса-Гастаута – редкие детские эпилепсии, для лечения которых существуют лишь ограниченные возможности. Положительные данные по фенфлурамину стимулировали интерес к потенциалу агонистов рецепторов 5HT2C для контроля припадков.
Исследования лоркасерина и других агонистов 5-HT2C рецепторов в моделях судорог ограничены. Сообщалось о положительном эффекте лоркасерина на частоту приступов у крыс GAERS [19]. Исследование с использованием тестов на судороги, которые обычно используются при разработке противоэпилептических препаратов (ПЭП), в целом показало, что лоркасерин (и агонисты рецепторов 5-HT2C в целом) неактивен [10]. Однако для контроля припадков фенфлурамин и другие ПЭП обычно используются в качестве дополнительной терапии, поэтому интерес представляют исследования комбинаций лоркасерина с другими препаратами.
Обезболивающие эффекты
Системное введение лоркасерина (0,3–3 мг/кг перорально) ослабляет мышечную гипералгезию, которая развивается у крыс в модели фибромиалгии, вызванной резерпином [20, 21]. Эти результаты позволяют предположить, что лоркасерин может иметь потенциал для лечения некоторых болевых состояний.
Фармакокинетика и безопасность
Фармакокинетические свойства лоркасерина у крыс [7] включают быстрое всасывание, высокую пероральную биодоступность и умеренный период полувыведения. После однократного перорального введения 10 мг/кг самцам крыс всасывание из желудочно-кишечного тракта в системную циркуляцию происходило быстро, и через 0,25 час вело к средней максимальной концентрации (Cmax) 0,760 мкг/мл, время до максимального проникновения в мозг – 1 час, где количество препарата было в 12–17 раз больше, чем в плазме. Пероральная биодоступность составляла 86%; период полураспада – 4,9 часа и 4,7 часа для плазмы и мозга, соответственно. Уровень препарата в плазме крови у самок был чуть выше, чем у самцов.
Фармакокинетические данные для лоркасерина также описаны для макак-крабоедов. Эффекты были аналогичны тем, которые были обнаружены у крыс. Лоркасерин быстро всасывался (Tmax<3,5 ч) и имел высокую пероральную биодоступность (49%). Соотношение ЦСЖ:плазма и мозг:плазма составило 0,1 и 10,1, соответственно.
Связывание лоркасерина с белками является умеренным и находится в диапазоне 60–76% у всех исследованных видов, включая человека. Выведение лоркасерина и его метаболитов с мочой является основным путем экскреции у всех видов, варьируясь от 61,9% от общей принятой дозы у крыс до 92,3% у человека. Основным метаболитом в моче является N-карбомоилглюкуронид лоркасерина.
В рамках оценки безопасности были отмечены легкие печеночные и почечные изменения. Исследования канцерогенности вызвали потенциальные опасения.
Клинические испытания
Эффективность лоркасерина рассматривалась в трех крупных клинических исследованиях продолжительностью 52 или 104 недели, где принимали участие пациенты с ожирением или избыточным весом: BLOSSOM [22]; BLOOM [23]; и BLOOM-DM [24]. В последнем лоркасерин оценивали конкретно у взрослых добровольцев с сахарным диабетом 2 типа.
В однолетнем исследовании BLOSSOM 4008 человек (18–65 лет при ИМТ ≥27 кг/м2 с более чем одним сопутствующим ожирению фактором или ИМТ 30–45 кг/м2 без наличия ССЗ или сахарного диабета) были рандомизированы в группы лечения: 2×10 мг/день лоркасерина, 10 мг один раз в день или плацебо; 55,5% участников завершили исследование. Обе дозировки лоркасерина помогли сбросить значительно больше веса, чем плацебо, причем при двухразовом приеме потеря была больше. Среднее процентное изменение от исходного уровня составило -2,8%, -5,8% и -4,7% в группах плацебо, 10 мг дважды и 10 мг лоркасерина один раз в день, соответственно, при этом 25,0%, 47,2% и 40,2% пациентов потеряли >5% от исходного веса [22].
В исследовании BLOOM (3182 пациента со средним ИМТ 36,2 кг/м2) оценивались первичные результаты применения лоркасерина (2×10 мг/день против плацебо) в течение года и поддержание потери веса в течение двух лет. Пациенты спустя год либо продолжали принимать плацебо, либо те, кто принимал лоркасерин, рандомизированы в контрольную группу или к приему лоркасерина еще 52 недели. По сравнению с другими группами, средняя масса тела оказалась ниже у принимавших лоркасерин в течение двух лет. Средняя потеря веса в группе лоркасерина была больше в течение первого года (-5,8 кг против -2,2 кг в плацебо), продолжаясь во второй год (-8,1 кг против -3,3 кг); потеря веса сохранялась у большего числа людей, потерявших >5% за первый год приема лоркасерина и продолжавших получать препарат, чем у тех, кто был переведен на плацебо во второй год (67,9% против 50,5%, соответственно) [23]. Использование лоркасерина в дозировке 10 мг дважды в день против плацебо также ассоциировалось со значительным улучшением вторичных конечных показателей липидного профиля, а также окружности талии.
В клиническом исследование BLOOM-DM участвовало 604 добровольца с сахарным диабетом 2 типа и исходным уровнем HbA1c 7–10%, принимающие метформин / сульфонилмочевину, с ожирением/избыточным весом и хотя бы одним связанным с ожирением сопутствующим заболеванием. Участники были распределены на группы приема лоркасерина 10 мг два раза в день (n=256; 66,6% от общего числа участников), лоркасерина 10 мг один раз в день (n=95; 78,9%) или плацебо (n=253; 61,2%). В группах лоркасерина наблюдалось статистически значимое снижение среднего процентного изменения массы тела от исходного уровня (-4,5% и -5,0% для 2×10 мг/день и 10 мг один раз в день, соответственно) по сравнению с плацебо (-1,5%) и большее снижение исходного уровня HbA1c (>0,5%) [24].
Пострегистрационные исследования
Ожирение и расстройства пищевого поведения, вторичные по отношению к другим медицинским заболеваниям
Условием одобрения лоркасерина FDA в 2012 году в качестве средства для лечения ожирения, явился постоянный мониторинг и изучение его безопасности. Испытание CAMELLIA-TIMI 61 (сердечно-сосудистые и метаболические эффекты; тромболиз при инфаркте миокарда) было организовано частично с этой целью. Второй целью стало изучение влияния лоркасерина на частоту перехода лиц с ожирением к диабету 2 типа [25]. В CAMELLIA-TIMI 61 12000 испытуемых были распределены на плацебо или лоркасерин (10 мг в сутки) в соотношении 1:1, медиана периода исследования – 3,3 года. Важными особенностями этого исследования были большой размер выборки и длительность [26]. CAMELLIA-TIMI 61 завершилось в 2018 году [25, 27].
Главным показателем эффективности в CAMELLIA-TIMA 61 было умеренное, плацебо-скорректированное уменьшение веса через года лечения (2,6 кг у пациентов с диабетом; 2,8 кг – преддиабетом; 3,3 кг – при нормогликемии). Лечение лоркасерином также снизило риск появления диабета на 19% при преддиабете, на 23% – без диабета [25]. Хотя изменения веса оказались скромными и схожими с результатами испытаний фазы 3, существовала субпопуляция с более высоким ответом на лоркасерин. Например, 37,4% лиц с диабетом, 39,7% с преддиабетом и 42,3% нормогликемических пациентов потеряли более 5% веса (соответствующие показатели плацебо составили 17%, 18,2%, 16,7%, соответственно), а в общей популяции 15% принимавших лоркасерин против 5% в группе плацебо, потеряли не менее 10% массы за год. Большее понижение ИМТ, уменьшение окружности талии, биомаркеров гликемии (например, HbA1c) также отмечалось после применения лоркасерина [25]. Вторым важным результатом исследования CAMELLIA-TIMA 61 стало то, что при среднем сроке наблюдения 3,3 года не было выявлено существенной разницы в основных неблагоприятных сердечно-сосудистых событиях между лоркасерином 2×10 мг/день и плацебо. Кроме того, подгруппа из не менее 4000 человек обследовалась с помощью эхокардиограмм на начальном этапе, каждые полгода в течение первых двух лет и, в дальнейшем, ежегодно для мониторинга частоты возникновения новой сердечной вальвулопатии, выявленной в соответствии с эхокардиографическими критериями. Важной вторичной конечной точкой была частота возникновения вальвулопатии в конце одного года. Среди 3270 пациентов, для которых были доступны данные ЭКГ от исходного уровня и через год, новая вальвулопатия встречалась редко: у 30 получавших лоркасерин (1,8%) против 22 получавших плацебо (1,3%), ни у одного из которых не было симптомов [28]. Кроме того, не было отмечено пагубного влияния на функцию почек [27].
Общий эффект лоркасерина на снижение веса, измеренный в исследованиях BLOOM, BLOSSOM, BLOOM-DM и CAMELLIA-TIMA 61, демонстрирует последовательную, но относительно скромную эффективность лоркасерина, сходную по величине с эффектом дексфенфлурамина.
Так как эффективность (декс)фенфлурамина для снижения веса усиливается при совместном приеме с фентермином, было проведено двойное слепое, рандомизированное, параллельно-групповое пилотное исследование продолжительностью 12 недель среди взрослых с избыточным весом и ожирением с целью изучения эффектов сочетания лоркасерина с фентермином (PETAL, NCT01987427). Основной целью PETAL было оценить, ассоциируется ли данная комбинация с увеличением частоты нежелательных явлений, потенциально связанных с избытком серотонина, по сравнению с приемом только лоркасерина [29]. В общей сложности 228 человек были рандомизированы на три группы лечения: только лоркасерин (2×10 мг/день; LOR BID) и комбинации лоркасерин 2×10 мг/день плюс фентермин-HCl 2×15 мг/день (LOR BID + 1PHEN BID) или фентермин-HCl 15 мг один раз в день (LOR BID + 1PHEN QD). Серотонинергические нежелательные явления включали головокружение, сухость во рту, головную боль, усталость, тошноту, бессонницу, диарею, рвоту и беспокойство. В ходе испытания частота возникновения хотя бы одного из этих нежелательных явлений составила 37,2% в группе LOR BID, 42,3% в группе LOR BID + 1PHEN QD и 40,5% в группе LOR BID + 1PHEN BID. Основной вывод, сделанный по результатам этого исследования, заключается в том, что совместное назначение фентермина с лоркасерином в испытанных комбинациях не увеличивает частоту серотониновых нежелательных явлений. Вторичной целью исследования PETAL было определить, наблюдается ли аддитивность в отношении потери веса и тяги к пище. Средняя потеря веса составила 3,5 кг (3,3%), 7,0 кг (6,7%) и 7,6 кг (7,2%) для групп LOR BID, LOR BID + 1PHEN QD и LOR BID 1PHEN BID, соответственно. По крайней мере 5% потери веса достигли 28,2% участников LOR BID, 59,0% LOR BID + 1PHEN QD и 70,9% участников LOR BID + 1PHEN BID [29]. Однако эти показатели эффективности снижения веса не корректируются относительно плацебо, поскольку такой контрольной группы не было. Тяга к еде измерялась с помощью опросника The Food Craving Inventory (FCI), и контроля приема пищи Control of Eating Questionnaire (COEQ). Субъекты во всех группах лечения показали улучшение от исходного уровня до 12-ой недели по общему баллу FCI, а также по подшкалам FCI для продуктов с высоким содержанием жира, сладостей, углеводов и фаст-фуда. Испытуемые во всех группах также сообщили об улучшении контроля над приемом пищи на 12-ой неделе по сравнению с исходным уровнем. Частота и сила тяги к шоколаду, сладостям, несладким и крахмалистым продуктам уменьшилась в исследуемой популяции, состоявшей на 85% из женщин [30]. Однако в отсутствие плацебо-контроля эти данные лучше считать предварительными.
Другие исследования фазы 4 с лоркасерином были посвящены изучению его действия при других состояниях, когда возможно увеличение веса. Сюда входят фармакокинетические исследования в педиатрии [31]; увеличение веса у курильщиков [32]; увеличение веса, вызванное антипсихотическими препаратами (NCT01962402), и комбинации с низкоинтенсивной лазерной терапией [33]. В случае набора веса, вызванного антипсихотическими препаратами, дополнительным положительным эффектом является то, что лоркасерин также может потенциально улучшать гликемический контроль [24, 25]. Таким образом, лоркасерин имеет ряд потенциальных преимуществ для здоровья людей с шизофренией, получающих лечение антипсихотическими препаратами.
Отказ от курения и сопутствующий набор веса
На основании доклинических исследований, показавших, что агонисты рецепторов 5-HT2C снижают самовведение никотина и рецидивы, лоркасерин был протестирован в исследовании фазы 2 по отказу от курения [34]. В плацебо-контролируемом 12-недельном эксперименте, в котором приняли участие более 600 курильщиков (курящие >10 сигарет в день без воздержания >3 месяцев в течение последнего года) лоркасерин (10 мг/кг дважды или 10 мг один раз в день) увеличил частоту непрерывного отказа от курения, измеренную на 9–12 неделях. Наибольший эффект был зарегистрирован в группе 2×10 мг/день (15,3% против 5,6% в группе плацебо), что согласуется с относительными результатами влияния этих дозировок на увеличение веса, зарегистрированными в исследованиях APD356-004 и BLOSSOM. Показатель непрерывного воздержания от курения в группе плацебо был довольно низким (5,6%), что может быть связано с включением в исследование испытуемых, которые были «закоренелыми курильщиками» или имели низкую мотивацию к отказу от курения. Результаты были достаточно обнадеживающими, чтобы поддержать исследование по изучению влияния лоркасерина в сочетании с никотиновым пластырем на симптомы абстиненции и отказ от курения (NCT02906644) [35]. Участие приняли 61 человек, которые были в равной степени рандомизированы для получения никотиновых пластырей и лоркасерина 2×10 мг/день или плацебо в течение двух недель, после чего все получали оба препарата 12 недель. Целевой датой отказа от курения был конец четвертой недели. Первичной конечной точкой, оцениваемой в конце второй недели, были симптомы абстиненции после двухчасового воздержания, измеряемые с помощью опросника. Основной вторичной конечной точкой было непрерывное четырехнедельное воздержание от курения в течение 11–14 недель. Вторую неделю завершили 57 испытуемых и 37 – 14-ую. Симптомы отмены схожи в обеих группах и после второй недели были близки и показатели непрерывного воздержания (29% в группе непрерывного и 33% в группе отсроченного приема лоркасерина). После двух недель комбинация лоркасерина и никотина не обеспечила большей защиты от симптомов абстиненции, чем одни только никотиновые пластыри.
Увеличение веса может стать препятствием как для попытки бросить курить, так и для воздержания после отказа от курения. Варениклин (Chantix®) является наиболее эффективным утвержденным препаратом для отказа от курения, но при этом оказывает минимальное влияние на увеличение веса после отказа от курения. В 12-недельном испытании лоркасерина для борьбы с курением у тех, кто достиг непрерывного воздержания от курения, доза 2×10 мг/день предотвратила небольшое увеличение веса, наблюдавшееся в двух других группах [34]. Изменение веса по сравнению с исходным уровнем составило +0,73±1,14, +0,76±0,47 и -0,41±0,58 кг в группах плацебо, лоркасерина 10 мг и лоркасерина 2×10 мг/день, соответственно.
Небольшое открытое клиническое пилотное исследование фазы 2 было проведено среди 20 курильщиков с избыточным весом или ожирением (ИМТ 27–40 кг/м2) для получения предварительных данных о безопасности и эффективности комбинации варениклина и лоркасерина для предотвращения увеличения веса после прекращения курения у курильщиков с избыточным весом и ожирением [32]. Все добровольцы получали варениклин (1 мг в сутки) и лоркасерин (10 мг в сутки) в течение 12 недель с последующим наблюдением через 26 недель. Десять участников соответствовали критериям длительного воздержания от курения на 12 неделе (50%) и шесть – на 26 неделе (30%). Среди тех, кто достиг длительного воздержания от курения на 12 неделе, увеличение веса составило +1,1±3,9 кг. Набор веса и увеличение окружности талии, связанные с отказом от курения, были минимизированы лоркасерином в сочетании с варениклином. Эти предварительные результаты подтверждают потенциальную пользу лоркасерина для снижения набора веса после отказа от курения. Основываясь на доклинических данных, лоркасерин может также иметь аддитивный эффект с варениклином в качестве потенциальной новой комбинации для фармакологического лечения табакокурения.
Кокаинизм и другие наркомании
В ряде клинических исследований лоркасерин также изучается в качестве средства для лечения злоупотребления кокаином. Самое крупное из них – с участием 250 добровольцев (NCT03007394). Задачей было оценить безопасность и эффективность лоркасерина (перорально, 2×10 мг/день) для лечения кокаинизма. Исследование завершено, однако подробные результаты не раскрыты.
Опубликованы результаты менее масштабного лабораторного исследования (NCT02680288) [36], где изучалось влияние однократного приема 10 мг лоркасерина на субъективные и подкрепляющие эффекты внутривенного кокаина с помощью рандомизированного двойного слепого исследования с перекрестным контролем в рамках субъекта. Хотя комбинированное лечение кокаином и лоркасерином было безопасным для испытуемых (n=9), лоркасерин не уменьшил мотивированное кокаином поведение или вызванный наркотиком «кайф». Более того, некоторые положительные субъективные эффекты кокаина оказались усилены лоркасерином. Таким образом, лоркасерин не снижал первичные показатели приема наркотиков или «кайфа», вызванного кокаином, хотя в некоторых условиях наблюдалось снижение тяги к наркотику [36]. Ограничения данного исследования включают небольшой размер выборки, однократную дозу лоркасерина и сомнительную мотивацию участников исследования отказаться от приема наркотиков.
В доклинических исследованиях сообщалось о положительном эффекте лоркасерина в облегчении соматических признаков отмены опиатов [37, 38]. Исследование комбинации лоркасерина (2×10 мг/день, перорально) с XR-налтрексоном для профилактики рецидивов у 60 человек с диагнозом «опиатное расстройство» (NCT03169816) завершено в 2019 году, однако результаты до сих пор не опубликованы.
Целью плацебо-контролируемого, внутрисубъектного лабораторного исследования на людях было изучение влияния лоркасерина на интоксикацию каннабисом и его самовведение [39]. Лоркасерин (2×10 мг/день) принимался во время одной из двух 13-дневных фаз стационарного лечения, а плацебо – во время другой; между каждой фазой прошло ≥7 дней вымывания. Стационарные фазы включали 1) стандартизированное введение каннабиса (7,0% ТГК), уравновешенное без интоксикации, 2) возможностью самостоятельного введения каннабиса после 0 или 3 дней воздержания. Также оценивались выполнение когнитивных задач, потребление пищи, субъективные оценки воздействия наркотика, объективные/субъективные показатели сна и употребление табачных сигарет. В исследовании приняли участие 15 человек с нормальным весом, ежедневно употребляющих каннабис (4 женщины, 11 мужчин), которые не обращались за лечением зависимости. Лоркасерин значительно снижал потребление каннабиса после 0 и 3 дней воздержания, а также снижал тягу. Лоркасерин вызвал небольшое, но значительное увеличение положительных оценок состояния и веса тела против плацебо. Лоркасерин в дни приема каннабиса также уменьшил курение табачных сигарет. Во время воздержания при приеме лоркасерина субъективные, но не объективные показатели качества сна ухудшались. В целом, способность лоркасерина снижать прием наркотиков и тягу к каннабису у его потребителей, не стремящихся к лечению, поддерживает дальнейшее его изучение в качестве потенциального фармакотерапевтического средства для лечения наркотических зависимостей.
Синдром Драве и другие эпилепсии
Под влиянием сообщений об уменьшении припадков у детей с синдромом Драве после лечения фенфлурамином был проведен ретроспективный анализ данных 35 человек, получавших лоркасерин с синдромом Драве (n=20), синдромом Леннокса-Гастаута (n=9) или другие устойчивые к лечению эпилепсии (n=6) [40]. Большинство пациентов (94,3%) принимали как минимум еще один противосудорожный препарат. Анализ выявил снижение числа моторных припадков во всех группах (50% – синдром Леннокса-Гастаута и 43% – Драве) в примерно два раза, чем обычно наблюдается после приема плацебо (10–20%). Хотя исследование имеет существенные ограничения (ретроспективный сбор данных, отсутствие ослепления и контрольной группы), оно подталкивает к рандомизированному исследованию лоркасерина для лечения резистентных эпилепсий [40].
Дозировки, побочные эффекты и безопасность
Наиболее распространенные побочные эффекты, о которых сообщали >2% пациентов, принимавших лоркасерин без сахарного диабета, включают головную боль, головокружение, усталость, тошноту, сухость во рту и запор [41]. У пациентов с сахарным диабетом, принимающих лоркасерин, нежелательные реакции включают гипогликемию (уровень глюкозы в крови <65 мг/дл), головную боль, боль в спине, назофарингит, кашель и усталость. Частота возникновения новой сердечной вальвулопатии в группах лоркасерина и плацебо не была статистически значимой во всех трех исследованиях BLOOM, BLOSSOM и BLOOM-DM; частота ухудшения также не была статистически значимой (12,1% при приеме лоркасерина дважды в день; 11,1% при приеме лоркасерина один раз в день; и 30,6% при приеме плацебо в BLOSSOM [22]. В объединенном анализе всех исследований фазы 3 лоркасерин не привел к негативному усилению сердечной вальвулопатии у пациентов с уже существующим заболеванием [24]. Лоркасерин следует назначать в дозе 10 мг два раза в день перорально или 20 мг пролонгированного высвобождения один раз в день с пищей или без нее. Прием лоркасерина надо прекратить, если в течение 12 недель достигнута <5% потеря веса, и не следует назначать его совместно с другим препаратом класса серотонинов, что может привести к нейролептическому злокачественному синдрому.
Хотя лоркасерин рекомендован в дозе 10 мг дважды в день, в клинических исследованиях 10 мг один раз в день давала такие же результаты по снижению веса, как и дозировка два раза в день [22, 24]. Препарат лоркасерина с пролонгированным высвобождением 20 мг один раз в день может быть хорошим вариантом для пациентов с сердечно-сосудистыми заболеваниями, которым следует избегать симпатомиметиков. Лоркасерин обладает меньшим потенциалом повышения частоты сердечных сокращений и артериального давления, чем фентермин и фентермин/топирамат.
Лоркасерин и рак
В феврале 2020 года FDA сообщило о повышенном риске развития рака при применении лоркасерина в ходе последующего наблюдения за исследованием CAMELLIA-TIMI 61 [42]. Позже Агентство потребовало отозвать препарат из оборота [43].
В систематическом обзоре и метаанализе [44] был рассмотрен вопрос о том, связан ли лоркасерин с более высокой частотой возникновения рака по сравнению с другими вмешательствами или отсутствием лечения. В работу включены четыре исследования, в которых сообщалось о 476 случаях рака у 10342 человек в группе лоркасерина и 438 у 9429 человек, рандомизированных для приема плацебо (относительный риск: 1,08). На результат в значительной степени повлияло исследование CAMELLIA-TIMI 61. В этом исследовании в группе лоркасерина был выше риск развития рака легких и поджелудочной железы, но не рака толстой кишки. Общий риск необъективности был низким, а качество доказательств – умеренным. Имеющиеся данные не подтверждают повышенный риск развития рака при использовании лоркасерина, но предполагают тенденцию в этом направлении, с большей частотой возникновения некоторых подтипов, таких как рак легких и поджелудочной железы.
Заключение
Лоркасерин демонстрирует хорошую эффективность для борьбы с ожирением и его переходом в диабет типа 2, а также может облегчать отказ от злоупотребления психотропными препаратами. С другой стороны, известна тенденция повышения риска развития рака легких и поджелудочной железы на фоне приема препарата.
Таким образом, еще предстоит выяснить, будет ли получено разрешение FDA на применение лоркасерина в ограниченных условиях. Среди возможных вариантов – в качестве краткосрочной дополнительной терапии к диете и физическим упражнениям, в более низкой дозе в комбинации с другими препаратами для снижения веса или у людей, демонстрирующих высокий ответ. Хотя применение лоркасерина для снижения веса и других показаний было отложено, рецептор 5-HT2C остается привлекательной мишенью для разработки фармацевтических препаратов с различными способами активации нейронных механизмов, обеспечивающих снижение веса и другие виды поведения.
Тезофензин для снижения веса
Глиптины: новый класс противодиабетических препаратов
1. Tremmel, M., Gerdtham, U.-G., Nilsson, P.M., Saha, S. Economic Burden of Obesity: A Systematic Literature Review. Int J Environ Res Public Health, 2017. 14, DOI: 10.3390/ijerph14040435.
2. Collaborators’, G.B.D.O., Health effects of overweight and obesity in 195 countries over 25 years. New England Journal of Medicine, 2017. 377(1): p. 13-27.
3. WO 2003086306 A2, 2003.
4. Belviq. Treatment for Obesity. Arena Pharmaceuticals Submits New Drug Application to FDA for Lorcaserin for Weight Management. 2009; Available from: https://www.drugs.com/nda/lorcaserin_091222.html.
5. Belviq (lorcaserin HCl) package insert https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/022529lbl.pdf (Arena Pharmaceuticals, 2012).
6. Higgins, G.A., Fletcher, P.J., Shanahan, W.R., Lorcaserin: A review of its preclinical and clinical pharmacology and therapeutic potential. Pharmacology & Therapeutics, 2020. 205: p. 107417. DOI: https://doi.org/10.1016/j.pharmthera.2019.107417.
7. Thomsen, W.J., Grottick, A.J., Menzaghi, F., Reyes-Saldana, H., Espitia, S., Yuskin, D., Whelan, K., Martin, M., Morgan, M., Chen, W., Al-Shamma, H., Smith, B., Chalmers, D., Behan, D., Lorcaserin, a novel selective human 5-hydroxytryptamine2C agonist: in vitro and in vivo pharmacological characterization. J Pharmacol Exp Ther, 2008. 325(2): p. 577-587. DOI: 10.1124/jpet.107.133348.
8. Smith, B.M., Smith, J.M., Tsai, J.H., Schultz, J.A., Gilson, C.A., Estrada, S.A., Chen, R.R., Park, D.M., Prieto, E.B., Gallardo, C.S., Sengupta, D., Dosa, P.I., Covel, J.A., Ren, A., Webb, R.R., Beeley, N.R.A., Martin, M., Morgan, M., Espitia, S., Saldana, H.R., Bjenning, C., Whelan, K.T., Grottick, A.J., Menzaghi, F., Thomsen, W.J., Discovery and Structure−Activity Relationship of (1R)-8-Chloro-2,3,4,5-tetrahydro-1-methyl-1H-3-benzazepine (Lorcaserin), a Selective Serotonin 5-HT2C Receptor Agonist for the Treatment of Obesity. Journal of Medicinal Chemistry, 2008. 51(2): p. 305-313. DOI: 10.1021/jm0709034.
9. Higgins, G.A., Silenieks, L.B., Roßmann, A., Rizos, Z., Noble, K., Soko, A.D., Fletcher, P.J., The 5-HT2C Receptor Agonist Lorcaserin Reduces Nicotine Self-Administration, Discrimination, and Reinstatement: Relationship to Feeding Behavior and Impulse Control. Neuropsychopharmacology, 2012. 37(5): p. 1177-1191. DOI: 10.1038/npp.2011.303.
10. Silenieks, L.B., Carroll, N.K., Van Niekerk, A., Van Niekerk, E., Taylor, C., Upton, N., Higgins, G.A., Evaluation of Selective 5-HT2C Agonists in Acute Seizure Models. ACS Chemical Neuroscience, 2019. 10(7): p. 3284-3295. DOI: 10.1021/acschemneuro.8b00739.
11. Grottick, A.J., Whelan, K., Sanabria, E.K., Behan, D.P., Morgan, M., Sage, C., Investigating interactions between phentermine, dexfenfluramine, and 5-HT2C agonists, on food intake in the rat. Psychopharmacology, 2015. 232(11): p. 1973-1982. DOI: 10.1007/s00213-014-3829-2.
12. Higgs, S., Cooper, A.J., Barnes, N.M., The 5-HT2C receptor agonist, lorcaserin, and the 5-HT6 receptor antagonist, SB-742457, promote satiety; a microstructural analysis of feeding behaviour. Psychopharmacology, 2016. 233(3): p. 417-424. DOI: 10.1007/s00213-015-4112-x.
13. Xu, P., He, Y., Cao, X., Valencia-Torres, L., Yan, X., Saito, K., Wang, C., Yang, Y., Hinton, A., Jr., Zhu, L., Shu, G., Myers, M.G., Jr., Wu, Q., Tong, Q., Heisler, L.K., Xu, Y., Activation of Serotonin 2C Receptors in Dopamine Neurons Inhibits Binge-like Eating in Mice. Biological Psychiatry, 2017. 81(9): p. 737-747. DOI: 10.1016/j.biopsych.2016.06.005.
14. Banks, M.L., Negus, S.S., Repeated 7-Day Treatment with the 5-HT2C Agonist Lorcaserin or the 5-HT2A Antagonist Pimavanserin Alone or in Combination Fails to Reduce Cocaine vs Food Choice in Male Rhesus Monkeys. Neuropsychopharmacology, 2017. 42(5): p. 1082-1092. DOI: 10.1038/npp.2016.259.
15. Burke, L.K., Ogunnowo-Bada, E., Georgescu, T., Cristiano, C., de Morentin, P.B.M., Valencia Torres, L., D’Agostino, G., Riches, C., Heeley, N., Ruan, Y., Rubinstein, M., Low, M.J., Myers, M.G., Rochford, J.J., Evans, M.L., Heisler, L.K., Lorcaserin improves glycemic control via a melanocortin neurocircuit. Molecular Metabolism, 2017. 6(10): p. 1092-1102. DOI: https://doi.org/10.1016/j.molmet.2017.07.004.
16. Collins, G.T., Gerak, L.R., France, C.P., The behavioral pharmacology and therapeutic potential of lorcaserin for substance use disorders. Neuropharmacology, 2018. 142: p. 63-71. DOI: https://doi.org/10.1016/j.neuropharm.2017.12.023.
17. Higgins, G.A., Fletcher, P.J., Therapeutic Potential of 5-HT2C Receptor Agonists for Addictive Disorders. ACS Chemical Neuroscience, 2015. 6(7): p. 1071-1088. DOI: 10.1021/acschemneuro.5b00025.
18. Howell, L.L., Cunningham, K.A., Serotonin 5-HT<sub>2</sub> Receptor Interactions with Dopamine Function: Implications for Therapeutics in Cocaine Use Disorder. Pharmacological Reviews, 2015. 67(1): p. 176. DOI: 10.1124/pr.114.009514.
19. Venzi, M., David, F., Bellet, J., Cavaccini, A., Bombardi, C., Crunelli, V., Di Giovanni, G., Role for serotonin2A (5-HT2A) and 2C (5-HT2C) receptors in experimental absence seizures. Neuropharmacology, 2016. 108: p. 292-304. DOI: https://doi.org/10.1016/j.neuropharm.2016.04.016.
20. Nagakura, Y., Oe, T., Aoki, T., Matsuoka, N., Biogenic amine depletion causes chronic muscular pain and tactile allodynia accompanied by depression: A putative animal model of fibromyalgia. PAIN, 2009. 146(1): p. 26-33. DOI: https://doi.org/10.1016/j.pain.2009.05.024.
21. Ogino, S., Nagakura, Y., Tsukamoto, M., Watabiki, T., Ozawa, T., Oe, T., Shimizu, Y., Ito, H., Systemic administration of 5-HT2C receptor agonists attenuates muscular hyperalgesia in reserpine-induced myalgia model. Pharmacology Biochemistry and Behavior, 2013. 108: p. 8-15. DOI: https://doi.org/10.1016/j.pbb.2013.04.007.
22. Fidler, M.C., Sanchez, M., Raether, B., Weissman, N.J., Smith, S.R., Shanahan, W.R., Anderson, C.M., Group, B.C.T., A one-year randomized trial of lorcaserin for weight loss in obese and overweight adults: the BLOSSOM trial. The Journal of clinical endocrinology and metabolism, 2011. 96(10): p. 3067-3077. DOI: 10.1210/jc.2011-1256.
23. Smith, S.R., Weissman, N.J., Anderson, C.M., Sanchez, M., Chuang, E., Stubbe, S., Bays, H., Shanahan, W.R., Behavioral, M., Lorcaserin for, O., Obesity Management Study, G., Multicenter, placebo-controlled trial of lorcaserin for weight management. The New England journal of medicine, 2010. 363(3): p. 245-256. DOI: 10.1056/nejmoa0909809.
24. O’Neil, P.M., Smith, S.R., Weissman, N.J., Fidler, M.C., Sanchez, M., Zhang, J., Raether, B., Anderson, C.M., Shanahan, W.R., Randomized Placebo-Controlled Clinical Trial of Lorcaserin for Weight Loss in Type 2 Diabetes Mellitus: The BLOOM-DM Study. Obesity, 2012. 20(7): p. 1426-1436. DOI: https://doi.org/10.1038/oby.2012.66.
25. Bohula, E.A., Scirica, B.M., Inzucchi, S.E., McGuire, D.K., Keech, A.C., Smith, S.R., et al., Effect of lorcaserin on prevention and remission of type 2 diabetes in overweight and obese patients (CAMELLIA-TIMI 61): a randomised, placebo-controlled trial. The Lancet, 2018. 392(10161): p. 2269-2279. DOI: https://doi.org/10.1016/S0140-6736(18)32328-6.
26. Unamuno, X., Frühbeck, G., Lorcaserin: balancing efficacy with potential risks. The Lancet, 2018. 392(10161): p. 2239-2240. DOI: https://doi.org/10.1016/S0140-6736(18)32460-7.
27. Scirica, B.M., Bohula, E.A., Dwyer, J.P., Qamar, A., Inzucchi, S.E., McGuire, D.K., Keech, A.C., Smith, S.R., Murphy, S.A., Im, K., Leiter, L.A., Gupta, M., Patel, T., Miao, W., Perdomo, C., Bonaca, M.P., Ruff, C.T., Sabatine, M.S., Wiviott, S.D., null, n., Lorcaserin and Renal Outcomes in Obese and Overweight Patients in the CAMELLIA-TIMI 61 Trial. Circulation, 2019. 139(3): p. 366-375. DOI: 10.1161/CIRCULATIONAHA.118.038341.
28. Bohula, E.A., Wiviott, S.D., McGuire, D.K., Inzucchi, S.E., Kuder, J., Im, K., Fanola, C.L., Qamar, A., Brown, C., Budaj, A., Garcia-Castillo, A., Gupta, M., Leiter, L.A., Weissman, N.J., White, H.D., Patel, T., Francis, B., Miao, W., Perdomo, C., Dhadda, S., Bonaca, M.P., Ruff, C.T., Keech, A.C., Smith, S.R., Sabatine, M.S., Scirica, B.M., Cardiovascular Safety of Lorcaserin in Overweight or Obese Patients. New England Journal of Medicine, 2018. 379(12): p. 1107-1117. DOI: 10.1056/NEJMoa1808721.
29. Smith, S.R., Garvey, W.T., Greenway, F.L., Zhou, S., Fain, R., Pilson, R., Fujioka, K., Aronne, L.J., Coadministration of lorcaserin and phentermine for weight management: A 12-week, randomized, pilot safety study. Obesity, 2017. 25(5): p. 857-865. DOI: https://doi.org/10.1002/oby.21811.
30. Rebello, C.J., Nikonova, E.V., Zhou, S., Aronne, L.J., Fujioka, K., Garvey, W.T., Smith, S.R., Coulter, A.A., Greenway, F.L., Effect of Lorcaserin Alone and in Combination with Phentermine on Food Cravings After 12-Week Treatment: A Randomized Substudy. Obesity, 2018. 26(2): p. 332-339. DOI: https://doi.org/10.1002/oby.22094.
31. Christopher, R.J., Morgan, M.E., Tang, Y., Anderson, C., Sanchez, M., Shanahan, W., Pharmacokinetics and Tolerability of Lorcaserin in Special Populations: Elderly Patients and Patients with Renal or Hepatic Impairment. Clinical Therapeutics, 2017. 39(4): p. 837-848.e837. DOI: 10.1016/j.clinthera.2017.03.004.
32. Hurt, R.T., Croghan, I.T., Schroeder, D.R., Taylor Hays, J., Choi, D.S., Ebbert, J.O., Combination varenicline and lorcaserin for tobacco dependence treatment and weight gain prevention in overweight and obese smokers: A pilot study. Nicotine and Tobacco Research, 2017. 19(8): p. 994-998. DOI: 10.1093/ntr/ntw304.
33. Croghan, I.T., Ebbert, J.O., Schroeder, D.R., Hurt, R.T., Hagstrom, V., Clark, M.M., A randomized, open-label pilot of the combination of low-level laser therapy and lorcaserin for weight loss. BMC Obesity, 2016. 3(1). DOI: 10.1186/s40608-016-0122-4.
34. Shanahan, W.R., Rose, J.E., Glicklich, A., Stubbe, S., Sanchez-Kam, M., Lorcaserin for Smoking Cessation and Associated Weight Gain: A Randomized 12-Week Clinical Trial. Nicotine Tob Res, 2017. 19(8): p. 944-951. DOI: 10.1093/ntr/ntw301.
35. Rose, J.E., Davis, J.M., Combination Lorcaserin and Nicotine Patch for Smoking Cessation Without Weight Gain. Nicotine Tob Res, 2020. 22(9): p. 1627-1631. DOI: 10.1093/ntr/ntz149.
36. Pirtle, J.L., Hickman, M.D., Boinpelly, V.C., Surineni, K., Thakur, H.K., Grasing, K.W., The serotonin-2C agonist Lorcaserin delays intravenous choice and modifies the subjective and cardiovascular effects of cocaine: A randomized, controlled human laboratory study. Pharmacology Biochemistry and Behavior, 2019. 180: p. 52-59. DOI: https://doi.org/10.1016/j.pbb.2019.02.010.
37. Wu, X., Pang, G., Zhang, Y.-M., Li, G., Xu, S., Dong, L., Stackman, R.W., Zhang, G., Activation of serotonin 5-HT2C receptor suppresses behavioral sensitization and naloxone-precipitated withdrawal symptoms in heroin-treated mice. Neuroscience Letters, 2015. 607: p. 23-28. DOI: https://doi.org/10.1016/j.neulet.2015.09.013.
38. Zhang, G., Wu, X., Zhang, Y.-M., Liu, H., Jiang, Q., Pang, G., Tao, X., Dong, L., Stackman, R.W., Activation of serotonin 5-HT2C receptor suppresses behavioral sensitization and naloxone-precipitated withdrawal symptoms in morphine-dependent mice. Neuropharmacology, 2016. 101: p. 246-254. DOI: https://doi.org/10.1016/j.neuropharm.2015.09.031.
39. Arout, C.A., Cooper, Z.D., Reed, S.C., Foltin, R.W., Comer, S.D., Levin, F.R., Haney, M., 5HT-2C agonist lorcaserin decreases cannabis self-administration in daily cannabis smokers. Addiction Biology, 2021. n/a(n/a): p. e12993. DOI: https://doi.org/10.1111/adb.12993.
40. Tolete, P., Knupp, K., Karlovich, M., DeCarlo, E., Bluvstein, J., Conway, E., Friedman, D., Dugan, P., Devinsky, O., Lorcaserin therapy for severe epilepsy of childhood onset. Neurology, 2018. 91(18): p. 837. DOI: 10.1212/WNL.0000000000006432.
41. Srivastava, G., Apovian, C.M., Current pharmacotherapy for obesity. Nature Reviews Endocrinology, 2018. 14(1): p. 12-24. DOI: 10.1038/nrendo.2017.122.
42. Safety clinical trial shows possible increased risk of cancer with weight-loss medicine Belviq, Belviq XR (lorcaserin). 2020; Available from: https://www.fda.gov/drugs/drug-safety-and-availability/safety-clinical-trial-shows-possible-increased-risk-cancer-weight-loss-medicine-belviq-belviq-xr.
43. FDA requests the withdrawal of the weight-loss drug Belviq, Belviq XR (lorcaserin) from the market. 2020; Available from: https://www.fda.gov/drugs/drug-safety-and-availability/fda-requests-withdrawal-weight-loss-drug-belviq-belviq-xr-lorcaserin-market.
44. de Andrade Mesquita, L., Fagundes Piccoli, G., Richter da Natividade, G., Frison Spiazzi, B., Colpani, V., Gerchman, F., Is lorcaserin really associated with increased risk of cancer? A systematic review and meta-analysis. Obesity Reviews, 2021. 22(3): p. e13170. DOI: https://doi.org/10.1111/obr.13170.