Ожирение и избыточный вес ведут к развитию многочисленных серьезных осложнений. В настоящее время разработан и находится в завершающей стадии исследований новый препарат для снижения веса – тезофензин (tesofensine), который модулирует синаптический обратный захват моноаминов, снижая частоту приема пищи и повышая затраты энергии. Тезофензин показал эффективность при ожирении, в том числе при диабете типа 2 и синдроме Прадера-Вилли. Препарат активен при пероральном применении и в небольших дозировках — от 0,5 мг. В настоящем обзоре рассмотрены вопросы безопасности и эффективности препарата, согласно данным клинических испытаний.
Ожирение
Ожирение давно превратилось в глобальную эпидемию, которая стимулирует возникновение множества сопутствующих заболеваний: сахарный диабет типа 2, дислипидемия, инсулинорезистентность, сердечно-сосудистые заболевания (инсульт и ишемия), различные типы рака (груди, почек, желчного пузыря, толстой кишки, простаты) и нервно-психические расстройства [1]. Эти сопутствующие заболевания приводят к инвалидности и сокращению продолжительности жизни. Ожирение характеризуется повышенным аномальным накоплением жира, которое может быть результатом дисбаланса энергетического гомеостаза, то есть повышенного потребления и снижения расхода энергии (например, из-за отсутствия физической активности). К основным этиопатологическим факторам ожирения относятся генетическая предрасположенность, малоподвижный образ жизни с недостаточным расходом энергии и факторы окружающей среды, например, потребление высококалорийной пищи. Во всем мире около 2,8 миллиона человек ежегодно умирают из-за наличия избыточного веса и/или ожирения [2]. Например, распространенность ожирения в США к 2018 году составляла 42,4% с поправкой на возраст, а тяжелого ожирения – 9,2% среди лиц в возрасте >20 лет. Средняя распространенность была одинаковой среди представителей обоих полов, но случи тяжелого были выше среди женщин. Среди лиц среднего возраста (40–59 лет) тяжелое ожирение имеет самую высокую распространенность [3].
Стратегии лечения ожирения включают изменение образа жизни, бариатрическую хирургию и фармакотерапию [4]. Доступные сейчас препараты от ожирения, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), включают фентермин, орлистат, лорказерин и лираглутид. Из-за сложной и многофакторной патофизиологии ожирения, монотерапия не является адекватной, поэтому зачастую применяются многоцелевые подходы для повышения терапевтической пользы. Комбинации, одобренные FDA, представляют собой препараты с замедленным высвобождением налтрексона/бупропиона и составы с пролонгированным высвобождением фентермина/топирамата [4]. Многие препараты, такие как тезофензин, комбинация бупропион/зонисамид, эксенатид, цетилистат, RM-493 (сетмеланотид), KD-026 и ремоглифлозина этабонат, находятся на разных этапах клинических исследований. Текущие разработки лекарств для лечения ожирения ориентированы на воздействие на центральные пути. Эти препараты, в основном, уменьшают потребление пищи и увеличивают расход энергии. Одним из новых потенциальных лекарственных средств такого типа, все еще находящемся на стадии клинически исследований, является тезофензин.
Тезофензин
Тезофензин (Tesofensine, NS-2330; (1R,2R,3S,5S)-3-(3,4-дихлорфенил)- 8-метил-2-(этоксиметил)-8-азабицикло[3.2.1]октан; CAS 195875-84-4) – это производное азабициклооктана, представляющее собой новое лекарство от ожирения, которое действует центрально путем тройного ингибирования обратного захвата моноаминов (Рис. 1).
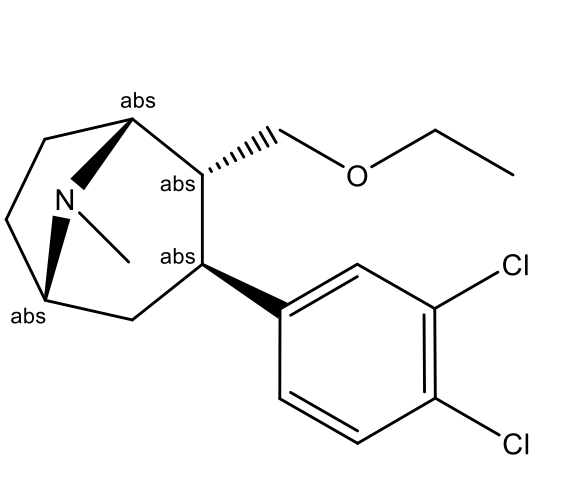
Рисунок 1 – Структурная формула тезофензина
Тезофензин модулирует синаптический обратный захват дофамина (DA), норэпинефрина (NE) и серотонина (5-HT) в синаптической щели [5]. Эти моноамины принимают ключевое участие в регуляции аппетита, расходе энергии и контроле массы тела. Тезофензин был первоначально разработан для лечения нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона [6-8]. Эффективность лечения данных заболеваний оказалась невысока [7, 9], но при этом сообщалось, что во время клинических исследований тезофензин вызывает серьезную потерю веса у пациентов, участвовавших в эксперименте, особенно у страдающих наличием избыточного веса или ожирения [10].
Результаты наблюдений подтолкнули исследователей к разработке тезофензина в качестве нового терапевтического агента для лечения ожирения, направленного на центральный обратный захват моноаминов и холинергическую нейротрансмиссию. Кроме того, исследование показало, что повышенная регуляция дофаминергических путей у субъектов, получавших тезофензин, оказалась следствием блокады DAT (переносчика дофамина) и последующего увеличения концентрации дофамина [11].
Тезофензин первоначально был разработан и запатентован компанией NeuroSearch A/S (Дания) для лечения болезни Паркинсона и болезни Альцгеймера. Первый синтез препарата описан в патенте [12], и, затем был усовершенствован [13]. В настоящее время работу над тезофензином ведут Saniona (Дания) в партнерстве с Productos Medix S.A. de C.V. (Мексика) [14].
Изначально тезофензин показал серьезную потерю веса в ходе исследования фазы I, и, следовательно, его перепрофилировали для лечения ожирения. Исследование фазы II показало, что даже доза тезофензина 0,5 мг в течение 24 недель способна вызвать значительную потерю веса. У умеренно здоровых мужчин тезофензин приводил к существенной потере веса за счет снижения аппетита и увеличения расхода энергии по сравнению с плацебо. В доклинических исследованиях было обнаружено, что тезофензин действует центрально, подавляя аппетит, регулируя доступность дофаминовых рецепторов и стимулируя α1-адренорецепторы. Также наблюдалась стимулирующая дофаминергическая реакция тезофензина в прилежащем ядре и префронтальной коре головного мозга. Кроме того, тезофензин изменяет экспрессию дофаминергических рецепторов в полосатом теле мозга, а также их связывание. Активная регуляция дофаминергического пути наблюдалась в результате увеличения синаптической доступности дофамина из-за дозозависимой блокады переносчика дофамина. Препарат имеет длительный период полувыведения, который составляет 8–9 дней, и в основном метаболизируется в печени с помощью CYP3A4 до дезалкильного метаболита M1 (NS-2360), который является единственным метаболитом, обнаруживаемым в плазме крови человека [2]. Далее в обзоре рассматриваются фармакологические аспекты тезофензина как потенциального средства против ожирения.
Доклинические и клинические исследования
При изучении терапии болезни Паркинсона было обнаружено, что тезофензин ингибирует обратный захват моноаминов DA, NE и 5-HT наряду со стимуляцией холинергических нейронов в префронтальной коре и гиппокампе [15].
Для изучения фармакодинамики вызванного тезофензином подавления аппетита, крысам с индуцированным диетой ожирением вводили тезофензин по 2 мг/кг подкожно в течение 16 дней [16]. Препарат значительно, до -25%, снизил массу тела животных, демонстрируя гипофагические эффекты с ED50 1,3 мг/кг. Высокие доза препарата (2 и 3 мг/кг) уменьшали общую массу потребляемой крысами пищи в 2,5–3 раза. Гипофагический ответ на тезофензин был отменен совместным введением антагониста α1-адренорецепторов, празозина, (1 мг/кг), и частично антагонизирован SCH-23390 (0,03 мг/кг). Напротив, антагонисты рецепторов D2, D3, α2- и 5-HT2A/C не влияли на гипофагию. Таким образом, было доказано, что тезофензин вызывает гипофагию за счет стимуляции рецепторов α1 и D1. В другом исследовании показали, что тезофензин столь же эффективен на грызунах, как и пероральный прием сибутрамина в дозировке 7,5 мг/кг [17].
На модели болезни Паркинсона, вызванной с помощью нейротоксичного МФТП у мартышек, он показал уменьшение проявлений симптомов Паркинсона без вызывания дискинезии. И наоборот, тезофензин сам по себе или в комбинации с леводопой не излечивал симптомы у пациентов с запущенной болезнью Паркинсона [6], а также у пациентов с ранней стадией заболевания [7]. В 2004 году исследования показали, что тезофензин умеренно улучшает прогрессирующую стадию болезни Паркинсона, но зависимости от дозы не было установлено. Более 20% пациентов ответили на терапию тезофензином и показали улучшение по подшкале II UPDRS (унифицированной рейтинговой шкале болезни Паркинсона) и общий балл по подшкале III. Тезофензин (0,5 мг) продемонстрировал статистически значимое улучшение показателей UPDRS по сравнению с плацебо. Однако умеренное улучшение симптомов, отсутствие зависимости доза-ответ и возникновение дискинезии были причиной неудачи и прекращения изучения тезофензина в качестве лекарственного средства для лечения болезни Паркинсона [9].
При болезни Альцгеймера тезофензин усиливал функцию основных нейротрансмиттеров, таким образом косвенно стимулируя холинергическую систему. Ацетилхолин играет ключевую роль в патофизиологии болезни Альцгеймера. Было обнаружено, что тесофенсин снижает уровень β-амилоида у мышей и обладает нейропротекторным действием. Тезофензин показал значительное улучшение когнитивных функций у пациентов с болезнью Альцгеймера в клинических испытаниях фазы IIa, но фаза IIb показала скомпрометированные результаты, и дальнейшие исследования были прекращены в 2008 году [18]. Исследования in vitro показали, что его метаболит (M1) имеет больший потенциал, чем исходный препарат. Исследования in vivo, проведенные на мышах в диапазоне дозировок тезофензина 0,3–20 мг/кг, также показали, что значение ЕС50 для M1 как ингибитора DAT в 4–6 раз выше [5]. Хотя препарат не проявил значительной эффективности при первоначальной терапии болезней Паркинсона и Альцгеймера, он действительно вызывал значительную потерю веса у пациентов [10].
Поскольку дефицит моноаминов в головном мозге является ключевым признаком депрессии, ингибиторы обратного захвата моноаминов, такие как 5-HT, NE и DA, могут быть полезны для поддержания нормальной физиологии мозга. Но тезофензин не исследовался ни доклинически, ни клинически на предмет наличия антидепрессивных свойств. На животных моделях было показано, что тесофенсин обладает нейропротекторной активностью за счет увеличения уровней нейротрофических факторов головного мозга, а также увеличения пролиферации нейронов гиппокампа крыс [8]. Это исследование продемонстрировало возможное значение тезофензина как нового фармакотерапевтического средства для лечения депрессии [19].
При ожирении тезофензин вызывал заметную потерю веса в исследовании фазы II, проведенном при изучении лечения болезней Альцгеймера и Паркинсона. Это открытие изменило весь процесс разработки лекарственного препарата. В метаанализе сравнили четыре исследования, в которых сообщалось о потере веса у пациентов с болезнью Альцгеймера и Паркинсона, получавших тезофензин. Результаты, полученные на 740 пациентах, показали, что 14-недельное лечение тезофензином (0,125, 0,25, 0,5 и 1,0 мг) приводило к потере веса дозозависимым образом (-0,5%, -0,9%, -1,8% и -2,8%, соответственно) по сравнению с плацебо (+0,5%) [10]. Анализ подгруппы с ожирением показал потерю веса ≥5% у 32% пациентов без применения диеты или изменения образа жизни. Также наблюдали изменение частоты сердечных сокращений (4–7 ударов в минуту) в зависимости от дозы. Похудание было связано с гипофагией (сокращение потребления пищи) и повышенным расходом энергии [10, 16]. Были необходимы дальнейшие исследования, чтобы изучить молекулярный механизм действия препарата против ожирения.
Для изучения механизм действия тезофензина на анорексигенный эффект, снижение веса и расход энергии у людей с избыточным весом или ожирением 32 здоровых добровольца получали ежедневно в течение 7 дней по 2 мг тезофензина [20]. Тезофензин вызвал потерю веса в среднем на 1,8 кг по сравнению с плацебо, наряду с пониженным потреблением пищи. Также наблюдались более высокие затраты энергии в течение ночи и увеличенное суточное окисление жиров по сравнению с плацебо.
Предпочтительный путь введения тезофензина – пероральный, поскольку он очень хорошо всасывается в желудочно-кишечном тракте. Стабильная концентрация в плазме может быть достигнута через 4–6 недель лечения тезофензином. Концентрация лекарственного средства в плазме увеличивалась по логарифмически-линейной зависимости от введенной дозы. Фармакокинетический профиль препарата является линейным после однократного и многократного приема во всех испытанных диапазонах доз, а расчетная абсолютная биодоступность после перорального приема превышает 90% [15]. Концентрация в плазме увеличивается с дозой, но четкой зависимости доза-ответ не наблюдалось. Для достижения максимальной концентрации в плазме (Cmax) требуется 6–8 часов. Наивысший достигнутый объем распределения (Vd) составил 600 л после внутривенного введения. Тезофензин метаболизируется преимущественно до соответствующего дезалкильного метаболита M1 ферментом CYP3A4. Тезофензин и М1 имеют длительный период полураспада, составляющий примерно 200 и 400 часов у человека, соответственно [6]. M1 является единственным обнаруживаемым метаболитом в организме человека, который имеет такие же фармакологические эффекты, как и исходное соединение, тогда как у мышей его активность в 5 раз меньше. Имея период полувыведения около 8 дней у людей, тезофензин может повышать концентрацию дофамина в полосатом теле без фазовых колебаний [9]. Клиренс креатинина был разным у мужчин и женщин: относительный общий клиренс около 1,92 л/ч у мужчин и 1,56 л/ч у женщин, последнее значение на 18,7% меньше, чем у мужчин [18].
Исследование фазы IIа (NCT03149445) представляло собой эксперимент, состоящий из двух частей, в котором проверялось терапевтическое воздействие перорального приема препарата Tesomet [комбинация фиксированных доз тезофензина и метопролола (син. вазокардин, корвитол, метолол)]. В первой части этого исследования – предварительные результаты были опубликованы в 2018 году – шесть взрослых с редким наследственным заболеванием, синдромом Прадера-Вилли (PWS), одним из симптомов которого является ожирение, ежедневно в течение трех месяцев применяли Tesomet (0,5 мг тезофензина и 50 мг метопролола), в то время как трое других пациентов получали плацебо. Результаты показали, что у тех, кто получал Tesomet, наблюдалась клинически значимая потеря веса и уменьшение чрезмерного переедания (гиперфагия). Изменение массы тела составило 6,76% в группе Tesomet по сравнению с 0,75% в группе плацебо; средняя окружность талии уменьшилась на 10 см у пациентов, получавших Tesomet, по сравнению с 6,5 см в группе плацебо. Уменьшение гиперфагии (аномально повышенного аппетита) также наблюдалось в конце исследования. Фактически, после одной недели лечения общий балл гиперфагии упал с 10 на исходном уровне до 5,67 в группе, принимавшей Tesomet, что эквивалентно снижению на 43%. Во второй части Tesomet (тезофензин 0,125 мг плюс метопролол 25 мг) исследовали на взрослых и подростках с PWS. Компания Saniona сообщает, что пациенты показали уменьшение веса, индекса массы тела (ИМТ) и показателя гиперфагии, измеряющего снижение аппетита, при лечении препаратом Tesomet в течение 24-недельного курса лечения [21]. Более высокая доза Tesomet (0,25 мг/день) оказала положительное влияние на массу тела и ИМТ у всех трех подростков с PWS по сравнению с плацебо и дозой 0,125 мг/день. В течение трех месяцев средняя масса тела трех пациентов снизилась на 2,6%, а их средний ИМТ снизился на 4,0%. Средний исходный балл для трех пациентов в начале исследования составлял 8,7. После 3-месячного периода приема более высокой дозы (0,25 мг/день Tesomet) средний балл составил 2,7, что на 69% меньше по сравнению с исходным уровнем. Отметим, что сочетание тезофензин и метопролол изучали в исследованиях NCT03488719 и NCT02737891.
На 60 пациентах с диабетом типа 2 была проведена оценка безопасности и эффективности совместного назначения тесофензина и метопролола (NCT02737891). Исследуемый препарат вводили в течение девяноста дней. Субъекты были случайным образом распределены в одну из двух групп (1:1), которым назначили Tesomet (0,5 мг тезофензина и 100 мг метопролола) или плацебо. В группе, получавшей препарат, средняя масса теkа снизилась на 3,5 кг против 0,3 кг в группе плацебо. У 3% пациентов отмечали сердцебиение и тахикардию.
На основании предыдущих исследований было установлено, что тезофензин в целом безопасен и эффективен, что подтверждается продолжающимися исследованиями. Однако у нескольких пациентов, получавших тезофензин, наблюдалась дискинезия, головная боль, тошнота, запор, галлюцинации и бессонница. Все сообщенные нежелательные явления были оценены как легкие. По результатам метаанализа, частота нежелательных явлений составила 20,4% в группе плацебо и 16,6% в объединенных группах лечения тезофензином [2]. Дискинезия является наиболее частым серьезным нежелательным явлением. В исследовании безопасности наблюдалось дозозависимое увеличение частоты сердечных сокращений. Среднее изменение частоты сердечных сокращений было следующим: плацебо: -0,8 ударов в минуту; группа 0,125 мг тезофензина: 4,7 ударов в минуту; 0,25 мг: 4,7 ударов в минуту; 0,5 мг: 5,6 ударов в минуту; и группа 1 мг: 6,7 ударов в минуту. Среднее изменение систолического артериального давления также было минимальным в группах лечения тезофензином (от -0,29 мм рт.ст. в группе 0,125 мг до -1,95 мм рт.ст. в группе 0,5 мг) по сравнению с небольшим увеличением (0,75 мм рт.ст.) в группе плацебо. Комбинация с метопрололом (Tesomet) разрабатывается для преодоления возникновения сердечных осложнений. Потеря веса наблюдалась у пациентов во всех группах лечения (-0,2 кг в группе плацебо, -0,3 кг в группе 0,125 мг, -0,7 кг в группе 0,25 мг, -0,6 кг в группе 0,5 мг и -1,1 кг в группе 1 мг) [7, 9]. Продолжающиеся в настоящее время клинические испытания могут дать больше информации о аспектах его безопасности. На сегодняшний день лекарственных взаимодействий с тезофензином не наблюдалось [2].
Заключение
Тезофензин – потенциально новое лекарство для похудания, которое в настоящее время проходит III фазу клинических исследований. Он продемонстрировал относительную безопасность и высокую эффективность в нескольких клинических испытаниях фазы I и II. Таким образом, тезофензин представляет собой средство для лечения пациентов с ожирением различной этиологии, включая диабет типа 2 и синдром Прадера-Вилли. Недавно компания Medix подала новую заявку в Управление по контролю за продуктами и лекарствами Мексики (Comisión Federal para la Protección contra Riesgos Sanitarios, COFEPRIS) с целью получения разрешения на применение тезофензина для лечения ожирения [22].
Лоркасерин: снижение аппетита и лечение ожирения
1. Obesity and overweight. World Health Organization. 2020; Available from: https://www.who.int/en/news-room/fact-sheets/detail/obesity-and-overweight.
2. Singh, R., Kumar, B., Kuhad, A., Tesofensine. Triple monoamine reuptake inhibitor of dopamine, norepinephrine and serotonin; Treatment of obesity. Drugs of the Future, 2018. 43(11): p. 809-814.
3. Prevalence of obesity and severe obesity among adults : United States, 2017–2018, H. National Center for Health Statistics . Division of, Nutrition Examination, S., Editors. 2020: Hyattsville, MD.
4. Srivastava, G., Apovian, C.M., Current pharmacotherapy for obesity. Nature Reviews Endocrinology, 2018. 14(1): p. 12-24. DOI: 10.1038/nrendo.2017.122.
5. Lehr, T., Staab, A., Tillmann, C., Nielsen, E.Ø., Trommeshauser, D., Schaefer, H.G., Kloft, C., Contribution of the active metabolite M1 to the pharmacological activity of tesofensine in vivo: a pharmacokinetic-pharmacodynamic modelling approach. British Journal of Pharmacology, 2008. 153(1): p. 164-174. DOI: 10.1038/sj.bjp.0707539.
6. Bara-Jimenez, W., Dimitrova, T., Sherzai, A., Favit, A., Mouradian, M.M., Chase, T.N., Effect of monoamine reuptake inhibitor NS 2330 in advanced Parkinson’s disease. Movement Disorders, 2004. 19(10): p. 1183-1186. DOI: 10.1002/mds.20124.
7. Hauser, R.A., Salin, L., Juhel, N., Konyago, V.L., Randomized trial of the triple monoamine reuptake inhibitor NS 2330 (tesofensine) in early Parkinson’s disease. Movement Disorders, 2007. 22(3): p. 359-365. DOI: 10.1002/mds.21258.
8. Larsen, M.H., Rosenbrock, H., Sams-Dodd, F., Mikkelsen, J.D., Expression of brain derived neurotrophic factor, activity-regulated cytoskeleton protein mRNA, and enhancement of adult hippocampal neurogenesis in rats after sub-chronic and chronic treatment with the triple monoamine re-uptake inhibitor tesofensine. European Journal of Pharmacology, 2007. 555(2): p. 115-121. DOI: https://doi.org/10.1016/j.ejphar.2006.10.029.
9. Rascol, O., Poewe, W., Lees, A., Aristin, M., Salin, L., Juhel, N., Waldhauser, L., Schindler, T., Group, A.S., Tesofensine (NS 2330), a Monoamine Reuptake Inhibitor, in Patients With Advanced Parkinson Disease and Motor Fluctuations: The ADVANS Study. Archives of Neurology, 2008. 65(5): p. 577-583. DOI: 10.1001/archneur.65.5.577.
10. Astrup, A., Meier, D.H., Mikkelsen, B.O., Villumsen, J.S., Larsen, T.M., Weight Loss Produced by Tesofensine in Patients With Parkinson’s or Alzheimer’s Disease. Obesity, 2008. 16(6): p. 1363-1369. DOI: 10.1038/oby.2008.56.
11. Appel, L., Bergström, M., Buus Lassen, J., Långström, B., Tesofensine, a novel triple monoamine re-uptake inhibitor with anti-obesity effects: Dopamine transporter occupancy as measured by PET. European Neuropsychopharmacology, 2014. 24(2): p. 251-261. DOI: https://doi.org/10.1016/j.euroneuro.2013.10.007.
12. WO 1997030997 A1, 1997.
13. US 7544802 B2, 2009.
14. About Saniona. 2020; Available from: https://saniona.com/about-saniona/.
15. Thatte, U., NS-2330 (Neurosearch). Current opinion in investigational drugs, 2001. 2(11): p. 1592-1594.
16. Axel, A.M.D., Mikkelsen, J.D., Hansen, H.H., Tesofensine, a Novel Triple Monoamine Reuptake Inhibitor, Induces Appetite Suppression by Indirect Stimulation of α1 Adrenoceptor and Dopamine D1 Receptor Pathways in the Diet-Induced Obese Rat. Neuropsychopharmacology, 2010. 35(7): p. 1464-1476. DOI: 10.1038/npp.2010.16.
17. Hansen, H.H., Hansen, G., Tang-Christensen, M., Larsen, P.J., Axel, A.M.D., Raben, A., Mikkelsen, J.D., The novel triple monoamine reuptake inhibitor tesofensine induces sustained weight loss and improves glycemic control in the diet-induced obese rat: Comparison to sibutramine and rimonabant. European Journal of Pharmacology, 2010. 636(1): p. 88-95. DOI: https://doi.org/10.1016/j.ejphar.2010.03.026.
18. Lehr, T., Staab, A., Tillmann, C., Trommeshauser, D., Raschig, A., Schaefer, H.G., Kloft, C., Population pharmacokinetic modelling of NS2330 (tesofensine) and its major metabolite in patients with Alzheimer’s disease. British Journal of Clinical Pharmacology, 2007. 64(1): p. 36-48. DOI: 10.1111/j.1365-2125.2007.02855.x.
19. Marks, D.M., Pae, C.-U., Patkar, A.A., Triple Reuptake Inhibitors: The Next Generation of Antidepressants. Current Neuropharmacology, 2008. 6(4): p. 338-343.
20. Sjödin, A., Gasteyger, C., Nielsen, A.L., Raben, A., Mikkelsen, J.D., Jensen, J.K.S., Meier, D., Astrup, A., The effect of the triple monoamine reuptake inhibitor tesofensine on energy metabolism and appetite in overweight and moderately obese men. International Journal of Obesity, 2010. 34(11): p. 1634-1643. DOI: 10.1038/ijo.2010.87.
21. Higher Dose of Tesomet Effective in PWS Adolescents, Saniona Reports. 2019; Available from: https://praderwillinews.com/2019/09/24/saniona-reports-higher-dose-tesomet-effective-adolescent-pws-patients/.
22. Medix Seeks Approval of Tesofensine to Treat Obesity in Mexico. 2020; Available from: https://praderwillinews.com/2020/01/02/medix-seeks-approval-tesofensine-obesity-mexico/.