Никотинамид рибозид – нуклеозид, сочетающий никотинамид (витамин B3) и рибозу, который стимулирует выработку никотинамидадениндинуклеотида (NAD+), регулирующего окислительно-восстановительные процессы и выработку энергии. В доклинических испытаниях никотинамид рибозид показал эффективность при сердечно-сосудистых, метаболических и нейродегенеративных заболеваниях, а так же, как средство, продляющее жизнь подопытных животных. В клинических исследованиях препарат оказался полезен при большинстве перечисленных состояний. Кроме того, никотинамид рибозид в составе аминокислотной добавки повышает иммунитет и может способствовать более быстрому выздоровлению пациентов с COVID-19. В обзоре рассмотрены результаты исследований никотинамид рибозида.
Общая характеристика
Никотинамид рибозид (Nicotinamide riboside, Niagen, TruNiagen, NR, 3-карбамоил-1-[(2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]пиридин-1-иум хлорид, 1-(β-D-Ribofuranosyl)nicotinamide, N-Ribosylnicotinamide; C11H15N2O5Cl; CAS 23111-00-4)
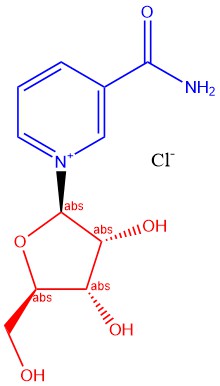
Рисунок 1 – Никотинамид рибозид
Никотинамид рибозид – это нуклеозид, в котором в одно химическое соединение объединены никотинамид и рибоза (Рис. 1; фрагменты выделены синим и красным, соответственно). Никотинамид рибозид естественным образом вырабатывается в дрожжах, бактериях и в тканях млекопитающих [1]. Механизмы, с помощью которых никотинамид рибозид образуется в биологических условиях, изучены слабо.
Никотинамид рибозид выделяется дрожжами, что позволяет предположить, что он может быть продуктом ферментативной деятельности дрожжей в продуктах питания. В пекарских дрожжах фосфатаза участвует в дефосфорилировании никотинамида мононуклеотида, в результате чего получается никотинамида рибозид. Пищевые продукты, наиболее обогащенные никотинамидом рибозидом включают дрожжевые изделия и фракции молочной сыворотки. Его количество в пище довольно мало и не превышает микромолярного диапазона.
За последние несколько лет были разработаны новые и надежные синтетические методы получения никотинамида рибозида [2]. Большинство синтетических путей получения солевых форм рибозида никотинамида можно разделить на две основные категории. Первый – это реакция между никотинамидом или его аналогами и перацилированной (галоген)-D-рибофуранозой, в результате чего образуется ацилированный промежуточный продукт, впоследствии превращающийся в целевую молекулу. Второй – конденсация N-(2,4-динитрофенил)-3-карбамоилпиридиниевой соли с производными D-рибофуранозиламина.
В июле 2013 года никотинамид рибозид стал доступен в форме добавки под торговой маркой NIAGEN (Chromadex Incorporated, Калифорния, США). Компания Biosynth Ag в 2021 году запатентовала получение кристаллических солей карбоновых кислот никотинамида рибозида, которые могут найти применение в фармацевтических композициях или как пищевые добавки [3]. Никотинамид рибозид, предшественник NAD+, является представителем семейства витаминов B3 (ниацин или никотинамид) и в настоящее время доступен в качестве безрецептурной БАД.
Биологическая роль никотинамида рибозида
Никотинамид рибозид является формальным предшественником никотинамидадениндинуклеотида (NAD+), кофермента, регулирующего окислительно-восстановительные процессы во всех метаболических путях и выработку энергии из питательных веществ [1]. Метаболическая судьба никотинамида рибозида в тканях млекопитающих была впервые исследована в 1951 году. Ученые предположили, что никотинамид рибозид в клетках подвергается фосфоролитичесой деградация до никотинамида. В настоящее время известно, что никотинамид рибозид может быть переработан Nrk-зависимым путем и что эта молекула может вести как мощный стимулятор производства NAD+ – в некоторых случаях избыточная выработка NAD+ достигала 270% от контроля. Эти данные позволили предположить, что никотинамид рибозид имеет уникальный метаболический путь к NAD+, не зависящий от других родственных соединений витамина B3 и обладающий выраженной способностью повышать уровень NAD+ [4].
β-никотинамид-аденин-динуклеотид, НАД+
Никотинамид рибозид нестабилен в крови. При комнатной температуре концентрация вещества и дейтерированного внутреннего стандарта, помещенного в кровь, уменьшалась на 8–14% за 30 мин [5]. Это существенно затрудняет оценку фармакокинетики и фармакодинамики никотинамида рибозида, внося ошибку в измерения. Исследования, проведенные как на мышах, так и на здоровых добровольцах, показали, что доза в 1000 мг дважды в день (всего 2000 мг) может значительно повысить уровень NAD+ в крови (до 2,7 раз после одного приема) и эффективно стимулировать метаболизм NAD+ [6]. Период полураспада в человеческом организме оценивается примерно в 2,7 часа. Эти исследования также подтвердили, что измеримый биологический эффект может быть достигнут при хроническом пероральном приеме препарата. Однако реакция NAD+ в крови не коррелировала с приемом никотинамида рибозида, а пик увеличения NAD+ был достигнут через девять дней [5]. Более того, высказывалось предположение, что для предотвращения значительных колебаний уровня никотинамида рибозида в организме из-за относительно короткого периода полувыведения потребуется многократное введение препарата. С другой стороны, наблюдавшаяся пероральная биодоступность при дозе 1000 мг сильно варьировалась между людей [5]. Нестабильность молекулы в образцах крови может быть одним из факторов, способствующих этому, хотя она не полностью объясняет такую изменчивость. Другое предложенное объяснение связано с низкой пассивной проницаемостью молекулы через слизистую оболочку кишечника человека. Метаболизм перорально введенного никотинамида рибозида является дискуссионным вопросом и требует дальнейших экспериментальных подтверждений.
Доклинические испытания
Чувствительность к инсулину, здоровье печени и другие метаболические функции
Наряду со своими промежуточными продуктами, NAD+ играет важную роль в метаболизме, и есть основания полагать, что повышение уровня NAD+ может улучшать метаболические нарушения, такие как диабет 2 типа (T2D), метаболический синдром и неалкогольная жировая болезнь печени [4]. Кроме того, никотинамид рибозид является одним из промежуточных продуктов NAD+, который также служит предшественником NADH, а также печеночных NADP+ и NADPH. Поскольку печеночный метаболом NAD+ рассматривается как функция преддиабетической и T2D мышиных моделей, NADP+ и NADPH могут быть использованы для оценки прогрессирования заболевания. NADP+ и NADPH важны для устойчивости к окислительному стрессу, в то время как NADPH, как полагают, вносит основной вклад в инсулинорезистентность.
Значительно сниженные уровни печеночных NADP+ и NADPH у мышей с Т2D восстанавливаются при введении никотинамида рибозида. В мышиных моделях никотинамид рибозид может увеличить метаболизм NAD+ и тем самым улучшить толерантность к глюкозе, уменьшить прирост веса и проявить нейропротекторный эффект против диабетической нейропатии и стеатоза печени. Аналогичным образом, в мышиных моделях ожирения, вызванного высоким содержанием жира, было показано, что доза вводимого с пищей никотинамида рибозида 400 мг/кг/день улучшает чувствительность к инсулину и защищает мышей от увеличения веса [7].
С другой стороны, есть данные, что введение никотинамид рибозид в мышиных моделях повышает активность SIRT1, важного фактора в профилактике T2D и сохранении чувствительности к инсулину. Более того, SIRT1 подавляет эффекты окислительного стресса у мышей с Т2D, способствует стимулированной глюкозой секреции инсулина из панкреатических β-клеток и защищает от инсулинорезистентности в периферических тканях. Накопление жира также снижается через механизм, включающий индукцию митохондриального ответа. В регенерирующей печени никотинамид рибозид понижает накопление липидов, способствует репликации гепатоцитов и увеличивает содержание печеночного АТФ, что приводит к более быстрому восстановлению веса печени у мышей [8]. Более того, пищевая добавка никотинамида рибозида смогла восстановить уровень NAD+, вызванный нарушением биосинтеза в мышиной модели гепатоцеллюлярной карциномы, и тем самым предотвратить повреждение ДНК и опухолевый генез [9].
В целом, известно достаточно подтверждений того, что повышение содержания NAD+ с помощью никотинамида рибозида может рассматриваться как перспективная терапевтическая стратегия при метаболических дисфункциях, включая T2D и неалкогольную жировую болезнь печени.
Влияние на сердечно-сосудистые заболевания
Нарушение гомеостаза NAD+ вследствие дисфункции митохондрий играет центральную роль в развитии гипертрофии сердца и сердечной недостаточности (СН) [4]. Кроме того, часто происходит переход от окисления жирных кислот и окислительного фосфорилирования к другим формам субстратного метаболизма (гликолизу и окислению кетонов), при этом соотношение NAD+/NADH также снижается. Изменение окислительно-восстановительной способности еще больше повышает восприимчивость сердца к стрессу.
Прием никотинамида рибозида нормализует соотношение NAD+/NADH в миокарде и проявляет защитные эффекты при неблагоприятном ремоделировании сердца, а длительный курс увеличивает ацетилирование нуклеоцитоплазматических белков, стимулируя метаболизм цитрата и ацетил-КоА, и экспрессию антиоксидантных генов. Улучшая гомеостаз NAD+ и активируя NMRK2, никотинамид рибозид может дополнительно предотвращать ухудшение сердечной функции и неблагоприятное ремоделирование, которые являются как ранними, так и постоянными событиями в мышиной модели дилатационной кардиомиопатии, ведущей к СН. Аналогичный сдвиг наблюдался в человеческом сердце в моделях кардиомиопатии [10]. Это позволяет предположить, что пероральный прием препарата или его предшественников является перспективным подходом к сохранению сердечной функции и ограничению ремоделирования при дилатационной кардиомиопатии.
Влияние на нейродегенеративные расстройства
Нейродегенеративные заболевания связаны с повреждениями ДНК, которые накапливаются с возрастом, и окислительным стрессом, приводящим к нарушению функции митохондрий [4]. Кроме того, истощение NAD+ наблюдается в процессе старения у многих животных, включая человека, и считается основным фактором риска развития болезни Альцгеймера (БА). При введении никотинамида рибозида в мышиных моделях БА, он оказывает благоприятное воздействие на окислительный стресс и восстановление ДНК, повышая уровень NAD+ [11]. Кроме того, никотинамид рибозид может улучшать другие аспекты нейропатологии БА, включая pTau, амилоид-β, нейрогенез, нейровоспаление, синаптическую пластичность гиппокампа и когнитивные функции. В частности, введение никотинамида рибозида уменьшает нейровоспаление и амилоидогенез во всем мозге мышей, получавших высокожировую диету, путем снижения уровней амилоида-β и нескольких маркеров воспаления (NLRP3, CASP1, IL-1, TNF-α и IL-6) всего за шесть недель [12]. Никотинамид рибозид может значительно улучшить протекание таких заболеваний, как синдром Коккейна, пигментная ксеродерма и атаксия-телеангиэктазия, в мышиных моделях, продлевая выживаемость более чем в три раза [13, 14].
Ранним событием, которое происходит при острой черепно-мозговой травме и при хронических нейродегенеративных заболеваниях, включая болезни Альцгеймера и Паркинсона, является аксональная дегенерации. В таких случаях она вызвана эксайтотоксичностью, которая является еще одной особенностью большинства нейродегенеративных заболеваний, поражающих центральную нервную систему. Интересно, что при эксайтотоксичности в нейронах обнаружено сильное истощение NAD+, в то время как мыши, которым вводили никотинамид рибозид, были защищены от вызванной дегенерации [15]. Этот нейропротекторный эффект зависит от содержания NAD+ как в митохондриях, так и в аксонах.
Общее снижение уровня NAD+ наблюдается при нервно-мышечных заболеваниях, которые часто вызваны наследственными мутациями, приводящими к прогрессирующей слабости и дегенерации скелетных мышц. Увеличение содержания NAD+ с помощью никотинамида рибозида может стимулировать производство энергии и улучшить функцию митохондрий. Было показано, что препарат оказывает терапевтическое действие при нескольких мышечных заболеваниях в мышиных моделях. Хотя добавка никотинамида рибозида не могла исправить генетические дефекты, она могла улучшить количество и функцию митохондрий при двух различных митохондриальных миопатиях [16, 17]. Более того, никотинамид рибозид может обратить вспять прогрессирующий синдром истощения скелетных мышц у мышей, лишенных Nampt, восстанавливая выносливость за одну неделю лечения [18]. Однако не ясно, имеет ли никотинамид рибозид значительные преимущества в тощих здоровых мышцах, поскольку у мышей, питавшихся обычным кормом, а не высокожировой диетой, наблюдалась лишь незначительная тенденция к повышению выносливости.
Снижение уровня NAD+ и экспрессии Nampt также наблюдались при мышечной дистрофии Дюшенна (МДД), состоянии, гистологически и транскрипционно сходном с синдромом прогрессирующей истощения. МДД также характеризуется повышенной активностью PARP, фиброзом и мышечной дегенерацией. Было обнаружено, что никотинамид рибозид улучшает мышечную функцию и патологию сердца у мышей mdx в модели МДД и снижает воспаление и фиброз [19]. Более того, показано, что никотинамид рибозид улучшает функцию стволовых клеток и тем самым смягчает фенотип истощения мышц у мышей mdx, что указывает на возможность его использования для лечения человека. Улучшение функции стволовых клеток, по-видимому, является общим явлением при введении никотинамида рибозида и, как предполагается, лежит в основе небольшого увеличения продолжительности жизни у мышей [20]. В целом, эти данные подтверждают, что никотинамид рибозид может быть эффективен в борьбе с прогрессированием мышечной дистрофии и дегенерации путем улучшения мышечной силы, омоложения стареющих мышечных стволовых клеток и снижения уровня воспаления и фиброза.
Влияние на продолжительность жизни
Ограничение калорий (CR) считается наиболее эффективным методом продления жизни у эукариот. Продлевающие жизнь эффекты CR могут быть частично опосредованы через усиление функции сиртуинов, а необходимость NAD+ для их активности указывает на возможную связь между старением и метаболизмом [4]. Однако пищевой подход к увеличению активности Sir2 и продолжительности жизни был реализован путем сверхэкспрессии гена в дрожжах, в то время как никотинамид не смог увеличить продолжительность жизни, а никотинамид – сократил ее. С другой стороны, никотинамид рибозид может повышать уровень NAD+ и функцию Sir2, а экзогенный препарат способствует Sir2-зависимой рекомбинации, улучшает сайленсинг генов и увеличивает продолжительность жизни без ограничения калорий [21]. Исследование на мышиных моделях показало, что однодневное голодание увеличивает NAD+ в печени [22], в то время как CR повышает NAD+ и снижает никотинамид в мозге [23]. Это означает, что повышенный уровень NAD+ в результате приема никотинамида рибозида, по-видимому, опосредует несколько полезных эффектов CR, способствуя продлению жизни через улучшение метаболизма и снижение хронического воспаления, характерного для старения.
Уролитин А (Urolithin A). Мышечная дистрофия и старение
Доклинические исследования показали, что никотинамид рибозид уменьшает инфильтрацию макрофагов в поврежденных мышцах и снижает уровень TNF-α в плазме крови в моделях жировой болезни печени. Точные механизмы, посредством которых никотинамид рибозид оказывает эти эффекты, остаются неясными, но описанное влияние на здоровье подопытных животных указывает на положительное влияние препарата на продолжительность жизни.
Клинические испытания
Старение
Выработка NAD+ находится под влиянием условий метаболического стресса и снижается по мере старения [24]. Никотинамид рибозид улучшал метаболическую дисфункцию у грызунов в доклинических экспериментах. В работе [25] авторы задались целью выяснить, может ли пероральный прием никотинамида рибозида пожилыми людьми оптимизировать метаболом (информацию о метаболитах и их взаимодействиях) NAD+ скелетных мышц и изменить биоэнергетику мышечных митохондрий. В ходе плацебо-контролируемого, рандомизированного, двойного слепого, перекрестного исследования 12 пожилым мужчинам назначили по 1 г никотинамида рибозида в день в течение трех недель. Анализы показали, что препарат улучшает метаболом NAD+ в мышцах, о чем свидетельствует увеличение продуктов распада аденин-динуклеотида никотиновой кислоты и никотинамида. Секвенирование мышечной РНК выявило вызванное приемом снижение регуляции энергетического метаболизма и путей митохондрий без изменения биоэнергетики митохондрий. Никотинамид рибозид также снизил уровни циркулирующих воспалительных цитокинов, включая интерлейкин 6 (IL-6) и интерлейкин 2 (IL-2) – в два раза, интерлейкин 5 (IL-5) – в четыре раза, фактор некроза опухоли альфа (TNF-a), интерферон-гамма (IFN-g), высокочувствительный С-реактивный белок (hsCRP) и интерлейкин 12 (IL-12) – на ~10% каждый. Данные свидетельствуют о доступности вводимого перорально никотинамида рибозида для мышц пожилых людей и подтверждают его противовоспалительное действие.
Сердечно-сосудистая система и мышцы
В обзоре [24] рассмотрено несколько статей о влиянии никотинамида рибозида на мышцы и функционирование сердечно-сосудистой системы функции у людей [25-29]. Все исследования являются рандомизированными, плацебо-контролируемыми клиническими исследованиями (РКИ), три из них – с перекрестным дизайном и одно – с параллельным. В целом эти РКИ характеризовались небольшим размером выборки (максимум 24 участника в группе), возраст варьировался от 20 до 80 лет. Дозировки никотинамида рибозида составляли от 500 до 2000 мг/день при продолжительности от одного дня до 12 недель. Каких-либо побочных реакций не наблюдалось даже при максимальной дозе. По сравнению с плацебо, прием никотинамида рибозида значительно увеличил концентрацию циркулирующего NAD+ – более чем в 2 раза [25], NADH – до 60% [26, 28], NMN – в 1,4 раза и NAAD – в 4,5 раза [25] при отличной безопасности и переносимости. Никотинамид рибозид повысил содержание NAAD и продуктов метаболизма NAD+ в мышцах, но не других маркеров. Кроме того, в одном из исследований никотинамид рибозид снижал уровень NAMPT в мышцах, что говорит о наличии механизма отрицательной обратной связи, которая ограничивает синтез NAD+ после воздействия экзогенного предшественника [29]. Такие различия в биодоступности препарата на уровне скелетных мышц могут зависеть от гетерогенности исследуемой популяции, например, от возраста и сопутствующих заболеваний.
Данные об эффективности препарата в улучшении физических и сердечной функций ограничены. Например, в работе [28] показали, что прием никотинамида рибозида 1000 мг/день в течение шести недель снижал систолическое и диастолическое артериальное давление у лиц с предгипертонией и уменьшал жесткость аорты у пациентов с более высоким исходным систолическим артериальным давлением. Другие показатели функции ССС, физической функции и метаболических параметров, однако, не изменились. В подгруппе из 12 пожилых мужчин (средний возраст – 71,5 лет) через два часа после однократного приема 500 мг никотинамида рибозида обнаружили значительное улучшение изометрической силы разгибателей колена (на 8%) и снижение утомляемости (на 15%), измеренное по процентному снижению крутящего момента между первыми пятью и последними пятью повторениями 30 максимальных концентрических сокращений ног при угловой скорости 180°/с [26].
Аналогичным образом, в выборке из 40 мужчин среднего возраста (от 40 до 70 лет), страдающих ожирением и ведущих сидячий образ жизни, хроническое лечение 2000 мг/день никотинамида рибозида в течение 12 недель не изменило экспрессию генов и уровень белков ферментов биосинтеза NAD+, не улучшило чувствительность к инсулину и не повлияло на GLUT4, гексокиназу II, мишень рапамицина млекопитающих (mTOR) и гликоген синтазу (GS) в скелетных мышцах. Кроме того, не было обнаружено изменений в энергозатратах в состоянии покоя, функции митохондрий, окислительной способности и сетевой организации митохондрий в скелетных мышцах. Препарат не изменил состав тела, оцененный с помощью рентгеновской абсорбциометрии всего тела с двумя уровнями энергии излучения (DXA), и не повлиял на внутри- и внемиоцеллюлярное отложение липидов в скелетных мышцах, измеренное с помощью 1H-МР-спектроскопии [25, 27].
На результаты, полученные в этих исследованиях, может влиять высокая вероятность ошибки второго типа, возникающей из-за малых размеров выборок. Вероятно, они были достаточно большими, чтобы обнаружить изменения в концентрациях метаболитов NAD+, но не в функциональных параметрах. Тем не менее, исходя из этих предварительных результатов, одного приема никотинамида рибозида может быть недостаточно для улучшения физической работоспособности. Учитывая, что положительный эффект регулярных тренировок часто ограничен у пожилых людей дисрегуляцией метаболизма NAD+, можно предположить, что сочетание физической нагрузки с приемом препарата может оптимизировать терапию у пожилых людей. В отличие от других комбинаций препаратов и упражнений, никотинамид рибозид может нормализовать метаболом NAD+ для улучшения расхода энергии и клеточных функций за счет облегчения адаптации к тренировкам.
Ожирение
Исследования на животных свидетельствуют о положительной роли никотинамида рибозида на чувствительность к инсулину и печеночный стеатоз в моделях ожирения и диабета 2 типа. Несмотря на то, что данные доклинических исследований выглядят убедительными, потенциальные эффекты и безопасность в клинических испытаниях на людях изучены недостаточно.
В рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании приняли участие 13 здоровых мужчин и женщин с избыточным весом или ожирением (NCT02835664) [30]. Участники в течение шести недель принимали никотинамид рибозид по 1000 мг/день или плацебо, после чего проводилось широкое метаболическое фенотипирование, включая гиперинсулинемический эугликемический зажим, магнитно-резонансную спектроскопию, биопсию мышц, оценку митохондриальной функции ex vivo и энергетического метаболизма in vivo. Маркеры синтеза NAD+ в скелетных мышцах – аденин динуклеотид никотиновой кислоты и метил никотинамид – были повышены после приема препарата по сравнению с плацебо. Никотинамид рибозид увеличил безжировую массу тела (62,65%±2,49% по сравнению с 61,32%±2,58% с сочетанием никотинамида рибозида и плацебо, соответственно; изменение: 1,34%±0,50%) и увеличил скорость метаболизма во сне. Интересно, что концентрация ацетилкарнитина в скелетных мышцах увеличилась после приема никотинамида рибозида (4558±749 против 3025±316 пмоль/мг сухого веса в группе приема препарата и плацебо, соответственно; изменение: 1533±683 пмоль/мг). Способность к образованию ацетилкарнитина при физической нагрузке была выше после никотинамида рибозида, чем после плацебо (2,99±0,30 по сравнению с 2,40±0,33 ммоль/кг влажного веса; изменение: 0,53±0,21 ммоль/кг). Однако не было обнаружено влияния никотинамида рибозида на чувствительность к инсулину, функцию митохондрий, накопление печеночных и внутриклеточных липидов, энергетический статус сердца, фракцию выброса сердца, артериальное давление, плазменные маркеры воспаления или энергетический метаболизм.
Иммуномодулирующее действие, противовирусная защита и COVID-19
Промежуточные продукты метаболизма NAD+ оказывают благоприятное воздействие на здоровье при различных инфекциях [4]. Исследования подтвердили противомикробный эффект у пациентов, инфицированных Mycobacterium tuberculosis, а также иммуноопосредованное уничтожение Staphylococcus aureus, Klebsiella pneumoniae и Pseudomonas aeruginosa. Кроме того, никотинамид и его аналоги проявляли противовирусный эффект у пациентов с ВИЧ и гепатитом В.
Недавно ученые предположили, что лечение с помощью промежуточных продуктов NAD+ может быть использовано для борьбы с инфекцией COVID-19, против которой в настоящее время не имеется эффективных терапевтических или профилактических средств. Коронавирус SARS-CoV-2 вызывает дезадаптивный иммунный ответ, приводящий к «цитокиновой буре» в легочной ткани, и лимфопении с резким снижением количества CD4+ и CD8+ Т-клеток [31]. На молекулярном уровне, по мере активации врожденного иммунного ответа, усиливается путь PARP. Ответ PARP необходим для ингибирования вирусной репликации. Белок nsp10 вируса SARS-CoV ингибирует перенос электронов на участке NADH комплекса I в митохондриальной электронно-транспортной цепи, поэтому, вероятно, ключевые события при врожденном иммунном ответе на вирусные инфекции происходят в метаболоме NAD+ инфицированной клетки [32].
В недавнем исследовании изучалась экспрессия PARP и дисрегуляция метаболома NAD+ в результате коронавирусной инфекции. В линиях клеток хорька, инфицированных SARS-CoV-2, и легких умерших пациентов были обнаружены нарушения метаболизма NAD+ и экспрессии генов, отвечающих за синтез и утилизацию NAD+ [32]. Более того, экспрессия пути NMRK1 была повышена вместе с экспрессией нуклеозидного транспортера CNT3, что указывает на более высокую способность никотинамида рибозида преобразовываться в NAD+ и NADP+ во время инфекции. Повышение экспрессии гена NMRK связано с терапевтической эффективностью никотинамида рибозида. Кроме того, экспрессия NNMT (никотинамид N-метилтрансферазы) была снижена из-за подавления метилирования NAM, что указывает на повышение эффективности никотинамида рибозида для восполнения NAD+. Таким образом можно восстановить противовирусные функции PARP для поддержки врожденного иммунитета против SARS-CoV-2 [32].
При активации адаптивного иммунного ответа сверхэкспрессия CD38 в CD4+ и CD8+ лимфоцитах еще больше усиливает истощение NAD+, что приводит к увеличению выработки и высвобождению провоспалительных цитокинов, реактивных форм кислорода и инфильтрации макрофагов. Более того, резкое истощение NAD+ нарушает функцию сиртуинов, регуляторов клеточной гибели и жизнеспособности. Восполнение NAD+ в организме может восстановить энергетический уровень и нарушенную функцию сиртуинов и, возможно, восстановить баланс дезадаптивного иммунного ответа на инфекцию SARS-CoV-2. Высокая эффективность родственного никотинамиду рибозиду витамина В3 в предотвращении повреждения легочной ткани была подтверждена на нескольких животных моделях с индуцированным повреждением легких [33]. Витамин В3 предложен в качестве раннего поддерживающего лечения против COVID-19. Важно, как отмечено выше, что никотинамид рибозид может снижать концентрации IL-2, IL-5, IL-6 и TNFα [25]. Это означает, что никотинамид рибозид следует рассматривать как потенциальный терапевтический или вспомогательный агент для снижения гиперинфляции и улучшения регенерации поврежденной легочной ткани.
В 2020 гожу медики провели плацебо-контролируемое клиническое исследование фазы 2 с участием ста амбулаторных пациентов с COVID-19 [34]. Участники были рандомизированы по принципу 3:1 в группы лечения гидроксихлорохином плюс CMCS (комбинированный прием кофакторов метаболизма – L-серина, N-ацетил-L-цистеина, никотинамида рибозида и L-карнитина тартрата; количества не указаны) или гидроксихлорохин плюс плацебо. Общий период лечения гидроксихлорохином составил пять дней, а CMCS/плацебо – 14 дней. Клинический статус оценивался ежедневно по телефону для определения наличия или отсутствия у испытуемого нескольких симптомов, связанных с COVID-19. Образцы плазмы для клинико-химических анализов собирались на 0-ый и 14-ый день. В общей сложности 93 пациента завершили исследование. Комбинация CMCS и гидроксихлорохина значительно сократила среднее время полного выздоровления по сравнению с гидроксихлорохином и плацебо (6,6 дня против 9,3 дня, соответственно) – почти на 30%. Кроме того, в группе гидроксихлорохина плюс CMCS наблюдалось значительное снижение уровней ферментов ALT, AST и LDH на 14-ый день. Побочные эффекты были редкими и незначительными.
На основании этих данных, предполагается, что прием никотинамида или никотинамида рибозида пациентами, страдающими от коронавирусной инфекции, может предотвратить передачу вируса путем ингибирования выработки цитокинов. Таким образом, он потенциально полезен для разрыва цепи передачи вируса, что поможет контролировать пандемию [35],
Дозировка и безопасность
Острый и хронический прием никотинамида рибозида хорошо переносится и повышает уровень NAD+ у здоровых взрослых среднего и пожилого возраста, как показано в работах [5, 28, 36]. Длительное введение препарата оценивалось на 30 добровольцах, которые принимали никотинамид рибозид по 500 мг, дважды в день в течение 12-недельного двойного слепого, плацебо-контролируемого перекрестного РКИ (NCT02921659) [28]. Только 2 из 30 зарегистрированных субъектов (<10%) выбыли из исследования из-за жалоб на побочные эффекты, причем оба случая произошли во время приема плацебо и включали головную боль и кожную сыпь. Других нежелательных реакций не наблюдалось. Ни один доброволец не выбыл во время курса приема никотинамида рибозида.
Безопасность подтвердилась и в другом исследовании, проведенном на 140 здоровых мужчинах и женщинах, которые принимали никотинамид рибозид в дозировках по 100, 300 и 1000 мг/день или плацебо в течение восьми недель [36]. Добровольцы не сообщали о гиперемии. Значительных различий в побочных явлениях между группами при различных дозах или при приеме плацебо не наблюдалось. Никотинамид рибозид также не повышал уровень холестерина липопротеинов низкой плотности и не нарушал метаболизм углеводов.
Метаанализ 11 опубликованных клинических исследований показал, что дозировка до 2000 мг/день продолжительностью до трех месяцев не вызывала серьезных побочных явлений [37].
Заключение
Открытия, касающиеся многочисленных полезных эффектов никотинамида рибозида в доклинических исследованиях, могут в конечном итоге привести к прорыву и позволить лечить большое количество метаболических и нейродегенеративных заболеваний. В настоящее время никотинамид рибозид изучается в значительном количестве клинических испытаний, включая исследования сердечно-сосудистых заболеваний, нейронных и когнитивных функций, метаболических нарушений, мышечных и почечных повреждений, старения, химиотерапии. Кроме того, фундаментальные исследования транспорта и метаболических путей никотинамида рибозида будут способствовать быстрому переходу к эффективному терапевтическому использованию.
Преимущества использования никотинамида рибозида перед альтернативными предшественниками NAD+, включая его безопасность и эффективность, предполагают в ближайшем будущем возможную замену ниацина в качестве биологически активной добавки. Данные свидетельствуют о доступности вводимого перорально никотинамида рибозида для мышц пожилых людей и подтверждают его противовоспалительное действие. Исходя из предварительных результатов, одного приема никотинамида рибозида может быть недостаточно для улучшения физической работоспособности. Учитывая, что положительный эффект регулярных тренировок зачастую ограничен у пожилых людей дисрегуляцией метаболизма NAD+, можно предположить, что сочетание тренировок с добавлением никотинамида рибозид способно оптимизировать терапию физическими упражнениями у пожилых людей. Однако использование никотинамида рибозид в качестве пищевой добавки все еще имеет определенные ограничения, поскольку результаты исследований на людях неоднозначны в отношении эффектов, оптимальных доз и продолжительности лечения. Последующие хорошо спланированные исследования никотинамида рибозида могли бы определить его как потенциальный элемент в терапии у пожилых людей. Будущие исследования должны ориентироваться на людей, которым необходимы физические упражнения в профилактических и терапевтических целях и которые также подвержены повышенному риску дефицита NAD+, например, пожилые люди с сопутствующими кардиометаболическими заболеваниями.
Прием никотинамида рибозид снижает уровень циркулирующих воспалительных цитокинов. У пациентов с легкой и средней степенью тяжести COVID-19 комбинированный прием кофакторов метаболизма (L-серина, N-ацетил-L-цистеина, никотинамида рибозида и L-карнитина тартрата) приводит к значительному сокращению времени выздоровления, по сравнению с плацебо, и ассоциируется с низкой частотой нежелательных явлений.
1. Chi, Y., Sauve, A.A., Nicotinamide riboside, a trace nutrient in foods, is a Vitamin B3 with effects on energy metabolism and neuroprotection. Current Opinion in Clinical Nutrition & Metabolic Care, 2013. 16(6).
2. Makarov, M.V., Migaud, M.E., Syntheses and chemical properties of β-nicotinamide riboside and its analogues and derivatives. Beilstein Journal of Organic Chemistry, 2019. 15: p. 401-430. DOI: 10.3762/bjoc.15.36.
3. WO 2021013795 A2, 2021.
4. Mehmel, M., Jovanović, N., Spitz, U., Nicotinamide Riboside—The Current State of Research and Therapeutic Uses. Nutrients, 2020. 12(6). DOI: 10.3390/nu12061616.
5. Airhart, S.E., Shireman, L.M., Risler, L.J., Anderson, G.D., Nagana Gowda, G.A., Raftery, D., Tian, R., Shen, D.D., O’Brien, K.D., An open-label, non-randomized study of the pharmacokinetics of the nutritional supplement nicotinamide riboside (NR) and its effects on blood NAD+ levels in healthy volunteers. PLOS ONE, 2017. 12(12): p. e0186459. DOI: 10.1371/journal.pone.0186459.
6. Trammell, S.A.J., Schmidt, M.S., Weidemann, B.J., Redpath, P., Jaksch, F., Dellinger, R.W., Li, Z., Abel, E.D., Migaud, M.E., Brenner, C., Nicotinamide riboside is uniquely and orally bioavailable in mice and humans. Nature Communications, 2016. 7(1): p. 12948. DOI: 10.1038/ncomms12948.
7. Cantó, C., Houtkooper, R.H., Pirinen, E., Youn, D.Y., Oosterveer, M.H., Cen, Y., Fernandez-Marcos, P.J., Yamamoto, H., Andreux, P.A., Cettour-Rose, P., Gademann, K., Rinsch, C., Schoonjans, K., Sauve, A.A., Auwerx, J., The NAD(+) precursor nicotinamide riboside enhances oxidative metabolism and protects against high-fat diet-induced obesity. Cell metabolism, 2012. 15(6): p. 838-847. DOI: 10.1016/j.cmet.2012.04.022.
8. Mukherjee, S., Chellappa, K., Moffitt, A., Ndungu, J., Dellinger, R.W., Davis, J.G., Agarwal, B., Baur, J.A., Nicotinamide adenine dinucleotide biosynthesis promotes liver regeneration. Hepatology, 2017. 65(2): p. 616-630. DOI: https://doi.org/10.1002/hep.28912.
9. Tummala, K.S., Gomes, A.L., Yilmaz, M., Graña, O., Bakiri, L., Ruppen, I., Ximénez-Embún, P., Sheshappanavar, V., Rodriguez-Justo, M., Pisano, D.G., Wagner, E.F., Djouder, N., Inhibition of de novo NAD(+) synthesis by oncogenic URI causes liver tumorigenesis through DNA damage. Cancer Cell, 2014. 26(6): p. 826-839. DOI: 10.1016/j.ccell.2014.10.002.
10. Diguet, N., Trammell, S.A.J., Tannous, C., Deloux, R., Piquereau, J., Mougenot, N., Gouge, A., Gressette, M., Manoury, B., Blanc, J., Breton, M., Decaux, J.-F., Lavery, G.G., Baczkó, I., Zoll, J., Garnier, A., Li, Z., Brenner, C., Mericskay, M., Nicotinamide Riboside Preserves Cardiac Function in a Mouse Model of Dilated Cardiomyopathy. Circulation, 2018. 137(21): p. 2256-2273. DOI: 10.1161/circulationaha.116.026099.
11. Gong, B., Pan, Y., Vempati, P., Zhao, W., Knable, L., Ho, L., Wang, J., Sastre, M., Ono, K., Sauve, A.A., Pasinetti, G.M., Nicotinamide riboside restores cognition through an upregulation of proliferator-activated receptor-γ coactivator 1α regulated β-secretase 1 degradation and mitochondrial gene expression in Alzheimer’s mouse models. Neurobiology of Aging, 2013. 34(6): p. 1581-1588. DOI: https://doi.org/10.1016/j.neurobiolaging.2012.12.005.
12. Lee, H.J., Yang, S.J., Supplementation with Nicotinamide Riboside Reduces Brain Inflammation and Improves Cognitive Function in Diabetic Mice. Int J Mol Sci, 2019. 20(17). DOI: 10.3390/ijms20174196.
13. Fang, E.F., Kassahun, H., Croteau, D.L., Scheibye-Knudsen, M., Marosi, K., Lu, H., Shamanna, R.A., Kalyanasundaram, S., Bollineni, R.C., Wilson, M.A., Iser, W.B., Wollman, B.N., Morevati, M., Li, J., Kerr, J.S., Lu, Q., Waltz, T.B., Tian, J., Sinclair, D.A., Mattson, M.P., Nilsen, H., Bohr, V.A., NAD(+) Replenishment Improves Lifespan and Healthspan in Ataxia Telangiectasia Models via Mitophagy and DNA Repair. Cell Metab, 2016. 24(4): p. 566-581. DOI: 10.1016/j.cmet.2016.09.004.
14. Scheibye-Knudsen, M., Mitchell, S.J., Fang, E.F., Iyama, T., Ward, T., Wang, J., Dunn, C.A., Singh, N., Veith, S., Hasan-Olive, M.M., Mangerich, A., Wilson, M.A., Mattson, M.P., Bergersen, L.H., Cogger, V.C., Warren, A., Le Couteur, D.G., Moaddel, R., Wilson, D.M., 3rd, Croteau, D.L., de Cabo, R., Bohr, V.A., A high-fat diet and NAD(+) activate Sirt1 to rescue premature aging in cockayne syndrome. Cell Metab, 2014. 20(5): p. 840-855. DOI: 10.1016/j.cmet.2014.10.005.
15. Vaur, P., Brugg, B., Mericskay, M., Li, Z., Schmidt, M.S., Vivien, D., Orset, C., Jacotot, E., Brenner, C., Duplus, E., Nicotinamide riboside, a form of vitamin B3, protects against excitotoxicity-induced axonal degeneration. The FASEB Journal, 2017. 31(12): p. 5440-5452. DOI: https://doi.org/10.1096/fj.201700221RR.
16. Cerutti, R., Pirinen, E., Lamperti, C., Marchet, S., Sauve, A.A., Li, W., Leoni, V., Schon, E.A., Dantzer, F., Auwerx, J., Viscomi, C., Zeviani, M., NAD(+)-dependent activation of Sirt1 corrects the phenotype in a mouse model of mitochondrial disease. Cell metabolism, 2014. 19(6): p. 1042-1049. DOI: 10.1016/j.cmet.2014.04.001.
17. Khan, N.A., Auranen, M., Paetau, I., Pirinen, E., Euro, L., Forsström, S., Pasila, L., Velagapudi, V., Carroll, C.J., Auwerx, J., Suomalainen, A., Effective treatment of mitochondrial myopathy by nicotinamide riboside, a vitamin B3. EMBO Molecular Medicine, 2014. 6(6): p. 721-731. DOI: https://doi.org/10.1002/emmm.201403943.
18. Frederick, D.W., Loro, E., Liu, L., Davila, A., Jr., Chellappa, K., Silverman, I.M., Quinn, W.J., 3rd, Gosai, S.J., Tichy, E.D., Davis, J.G., Mourkioti, F., Gregory, B.D., Dellinger, R.W., Redpath, P., Migaud, M.E., Nakamaru-Ogiso, E., Rabinowitz, J.D., Khurana, T.S., Baur, J.A., Loss of NAD Homeostasis Leads to Progressive and Reversible Degeneration of Skeletal Muscle. Cell Metab, 2016. 24(2): p. 269-282. DOI: 10.1016/j.cmet.2016.07.005.
19. Ryu, D., Zhang, H., Ropelle, E.R., Sorrentino, V., Mázala, D.A., Mouchiroud, L., Marshall, P.L., Campbell, M.D., Ali, A.S., Knowels, G.M., Bellemin, S., Iyer, S.R., Wang, X., Gariani, K., Sauve, A.A., Cantó, C., Conley, K.E., Walter, L., Lovering, R.M., Chin, E.R., Jasmin, B.J., Marcinek, D.J., Menzies, K.J., Auwerx, J., NAD+ repletion improves muscle function in muscular dystrophy and counters global PARylation. Sci Transl Med, 2016. 8(361): p. 361ra139. DOI: 10.1126/scitranslmed.aaf5504.
20. Zhang, H., Ryu, D., Wu, Y., Gariani, K., Wang, X., Luan, P., D’Amico, D., Ropelle Eduardo, R., Lutolf Matthias, P., Aebersold, R., Schoonjans, K., Menzies Keir, J., Auwerx, J., NAD+ repletion improves mitochondrial and stem cell function and enhances life span in mice. Science, 2016. 352(6292): p. 1436-1443. DOI: 10.1126/science.aaf2693.
21. Belenky, P., Racette, F.G., Bogan, K.L., McClure, J.M., Smith, J.S., Brenner, C., Nicotinamide riboside promotes Sir2 silencing and extends lifespan via Nrk and Urh1/Pnp1/Meu1 pathways to NAD+. Cell, 2007. 129(3): p. 473-484. DOI: 10.1016/j.cell.2007.03.024.
22. Rodgers, J.T., Lerin, C., Haas, W., Gygi, S.P., Spiegelman, B.M., Puigserver, P., Nutrient control of glucose homeostasis through a complex of PGC-1α and SIRT1. Nature, 2005. 434(7029): p. 113-118. DOI: 10.1038/nature03354.
23. Qin, W., Yang, T., Ho, L., Zhao, Z., Wang, J., Chen, L., Zhao, W., Thiyagarajan, M., MacGrogan, D., Rodgers, J.T., Puigserver, P., Sadoshima, J., Deng, H., Pedrini, S., Gandy, S., Sauve, A.A., Pasinetti, G.M., Neuronal SIRT1 Activation as a Novel Mechanism Underlying the Prevention of Alzheimer Disease Amyloid Neuropathology by Calorie Restriction *<sup> </sup>. Journal of Biological Chemistry, 2006. 281(31): p. 21745-21754. DOI: 10.1074/jbc.M602909200.
24. Custodero, C., Saini, S.K., Shin, M.J., Jeon, Y.K., Christou, D.D., McDermott, M.M., Leeuwenburgh, C., Anton, S.D., Mankowski, R.T., Nicotinamide riboside-A missing piece in the puzzle of exercise therapy for older adults? Exp Gerontol, 2020. 137: p. 110972-110972. DOI: 10.1016/j.exger.2020.110972.
25. Elhassan, Y.S., Kluckova, K., Fletcher, R.S., Schmidt, M.S., Garten, A., Doig, C.L., Cartwright, D.M., Oakey, L., Burley, C.V., Jenkinson, N., Wilson, M., Lucas, S.J.E., Akerman, I., Seabright, A., Lai, Y.-C., Tennant, D.A., Nightingale, P., Wallis, G.A., Manolopoulos, K.N., Brenner, C., Philp, A., Lavery, G.G., Nicotinamide Riboside Augments the Aged Human Skeletal Muscle NAD(+) Metabolome and Induces Transcriptomic and Anti-inflammatory Signatures. Cell reports, 2019. 28(7): p. 1717-1728.e1716. DOI: 10.1016/j.celrep.2019.07.043.
26. Dolopikou, C.F., Kourtzidis, I.A., Margaritelis, N.V., Vrabas, I.S., Koidou, I., Kyparos, A., Theodorou, A.A., Paschalis, V., Nikolaidis, M.G., Acute nicotinamide riboside supplementation improves redox homeostasis and exercise performance in old individuals: a double-blind cross-over study. European Journal of Nutrition, 2020. 59(2): p. 505-515. DOI: 10.1007/s00394-019-01919-4.
27. Dollerup, O.L., Christensen, B., Svart, M., Schmidt, M.S., Sulek, K., Ringgaard, S., Stødkilde-Jørgensen, H., Møller, N., Brenner, C., Treebak, J.T., Jessen, N., A randomized placebo-controlled clinical trial of nicotinamide riboside in obese men: safety, insulin-sensitivity, and lipid-mobilizing effects. The American journal of clinical nutrition, 2018. 108(2): p. 343-353. DOI: 10.1093/ajcn/nqy132.
28. Martens, C.R., Denman, B.A., Mazzo, M.R., Armstrong, M.L., Reisdorph, N., McQueen, M.B., Chonchol, M., Seals, D.R., Chronic nicotinamide riboside supplementation is well-tolerated and elevates NAD+ in healthy middle-aged and older adults. Nature Communications, 2018. 9(1): p. 1286. DOI: 10.1038/s41467-018-03421-7.
29. Dollerup, O.L., Chubanava, S., Agerholm, M., Søndergård, S.D., Altıntaş, A., Møller, A.B., Høyer, K.F., Ringgaard, S., Stødkilde-Jørgensen, H., Lavery, G.G., Barrès, R., Larsen, S., Prats, C., Jessen, N., Treebak, J.T., Nicotinamide riboside does not alter mitochondrial respiration, content or morphology in skeletal muscle from obese and insulin-resistant men. The Journal of physiology, 2020. 598(4): p. 731-754. DOI: https://doi.org/10.1113/JP278752.
30. Remie, C.M.E., Roumans, K.H.M., Moonen, M.P.B., Connell, N.J., Havekes, B., Mevenkamp, J., Lindeboom, L., de Wit, V.H.W., van de Weijer, T., Aarts, S.A.B.M., Lutgens, E., Schomakers, B.V., Elfrink, H.L., Zapata-Pérez, R., Houtkooper, R.H., Auwerx, J., Hoeks, J., Schrauwen-Hinderling, V.B., Phielix, E., Schrauwen, P., Nicotinamide riboside supplementation alters body composition and skeletal muscle acetylcarnitine concentrations in healthy obese humans. The American journal of clinical nutrition, 2020. 112(2): p. 413-426. DOI: 10.1093/ajcn/nqaa072.
31. Diao, B., Wang, C., Tan, Y., Chen, X., Liu, Y., Ning, L., Chen, L., Li, M., Liu, Y., Wang, G., Yuan, Z., Feng, Z., Zhang, Y., Wu, Y., Chen, Y. Reduction and Functional Exhaustion of T Cells in Patients With Coronavirus Disease 2019 (COVID-19). Frontiers in immunology, 2020. 11, 827 DOI: 10.3389/fimmu.2020.00827.
32. Heer, C.D., Sanderson, D.J., Voth, L.S., Alhammad, Y.M.O., Schmidt, M.S., Trammell, S.A.J., Perlman, S., Cohen, M.S., Fehr, A.R., Brenner, C., Coronavirus infection and PARP expression dysregulate the NAD metabolome: An actionable component of innate immunity. The Journal of biological chemistry, 2020. 295(52): p. 17986-17996. DOI: 10.1074/jbc.RA120.015138.
33. Shi, Y., Wang, Y., Shao, C., Huang, J., Gan, J., Huang, X., Bucci, E., Piacentini, M., Ippolito, G., Melino, G., COVID-19 infection: the perspectives on immune responses. Cell Death & Differentiation, 2020. 27(5): p. 1451-1454. DOI: 10.1038/s41418-020-0530-3.
34. Altay, O., Yang, H., Aydın, M., Alkurt, G., Altunal, L.N., Kim, W., Akyol, D., Arif, M., Zhang, C., Dinler-Doganay, G., Combined metabolic cofactor supplementation accelerates recovery in mild-to-moderate COVID-19 Running title: Metabolic cofactor supplementation in COVID-19. medRxiv, 2020. DOI: https://doi.org/10.1101/2020.10.02.20202614.
35. Gharote, M.A., Potential Role of Nicotinamide Supplementation in Prevention of Global Covid-19 Transmission. J Clin Case Rep On, 2021. 1(1): p. 1008.
36. Conze, D., Brenner, C., Kruger, C.L., Safety and Metabolism of Long-term Administration of NIAGEN (Nicotinamide Riboside Chloride) in a Randomized, Double-Blind, Placebo-controlled Clinical Trial of Healthy Overweight Adults. Scientific Reports, 2019. 9(1): p. 9772. DOI: 10.1038/s41598-019-46120-z.
37. Idoine, R., Erickson, A., Shao, A., Ishtiaq, Y., Roberts, M., Nkrumah-Elie, Y., Assessment of Clinical Research Outcomes for Personalizing Nicotinamide Riboside Dosing. Current Developments in Nutrition, 2020. 4(Supplement_2): p. 34-34. DOI: 10.1093/cdn/nzaa040_034.