Тревожность и тревожные расстройства широко распространены в мире. Магнолия лекарственная является традиционным фитопрепаратом китайской, японской и корейской народной медицины, который применяют для снижения тревожности. Одним из активных компонентов магнолии выступает хонокиол. На его основе был синтезирован более мощный препарат – дигидрохонокиол-B (DHH-B). Дигидрохонокиол-B обладает анксиолитическим действием и не вызывает значительных изменений в двигательной активности или мышечной релаксации. В обзоре рассматриваются результаты испытаний DHH-B на животных, обсуждается его перспективность как альтернативы препаратам бензодиазепинового ряда, а также злоупотребление магнолией и ее активными веществами.
Тревожность и расстройства, связанные с тревогой, чрезвычайно распространены – до 6,6% населения, в зависимости от страны [1]. По различным оценкам, число пациентов, страдающих различными тревожными расстройствами, колеблется от 12 до 35 миллионов человек в семи основных промышленно-развитых странах. Связанные с тревогой состояния могут быть относительно легкими или же достаточно тяжелыми и приводить к инвалидности. Также следует отметить, что тревога, хотя и редко является самостоятельным «заболеванием», выступает почти неизбежным и часто усугубляющим следствием многих других медицинских и хирургических состояний. На распространенность тревожности отрицательно сказалась пандемия COVID-19 – во время периодов изоляции наблюдалось значительное увеличение доли пациентов, нуждающихся в острой психиатрической помощи [2].
Наиболее распространенным методом лечения тревоги является применение одного из классов анксиолитических средств – бензодиазепинов, особенно диазепама и алпразолама. Бензодиазепины относятся к одними из наиболее часто назначаемых лекарств в США. Бензодиазепины могут противодействовать тревоге путем угнетения электрического послеразрядного возбуждения в лимбической системе и, возможно, ингибируют передачу нервных импульсов, опосредованную гамма-аминомасляной кислотой (ГАМК). Эти соединения доказали свою эффективность в снижении тревоги, но они также имеют значительные побочные эффекты, включая седацию, атаксию, амнезию, зависимость, толерантность и нарушения поведения, и действуют как релаксаторы скелетных мышц. Следовательно, применимость бензодиазепинов для многих пациентов ограничена, особенно для тех, чья тревога связана с другой имеющейся формой заболевания.
Китайский и японский травяной препарат Saiboku-To давно используется для лечения различных заболеваний, включая тревожность [3]. Недостатком Saiboku-To является то, что он требует ежедневного приема в течение приблизительно семи дней или более, прежде чем проявится анксиолитический эффект. Считается, что Saiboku-To оказывает свое действие через ГАМК/бензодиазепиновые рецепторы. Saiboku-To состоит из десяти трав. Одно из этих растений, Magnolia officinalis, было определено как основной источник анксиолитической активности. Кора магнолии лекарственной, как классический традиционный растительный препарат, насчитывает историю продолжительностью около 2000 лет в Китае, Японии, Южной Корее и других азиатских странах [4]. Химические компоненты M. officinalis включают фенолы, алкалоиды и летучие масла. Из магнолии было выделено и идентифицировано более 200 соединений.
Анксиолитический эффект Saiboku-To связан с компонентами Magnolia officinalis – хонокиолом. Далее мы рассмотрим синтетическое производное хонокиола – дигидрохонокиол-B и его биологическую активность.
Общая характеристика
Дигидрохонокиол-B (DHH-B, Dihydrohonokiol 3’-(2-пропенил)-5-пропил-(1,1’-бифенил)-2,4’-диол]; 2-(3-аллил-4-гидроксифенил)-4-пропилфенол; CAS 219565-74-9)
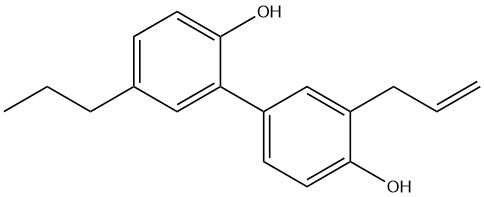
Magnoliae Cortex, кора Magnolia officinalis – это китайский неочищенный препарат, используемый в качестве угнетающего средства, для снятия тургора (опухания) тореко-абдоминальной области, а также как желудочное [5].
Химическое исследование коры магнолии, произведенной в Китае, в 1991 году привело к выделению восемнадцати новых лигнанов и родственных соединений: четыре монотерпенил-лигнана – пиперитилмагнолол, дипиперитилмагнолол, пиперитилхонокиол и борнилмагнолол; семь лигнанов – магнальдегиды B, C, магнолигнаны A, B, C, D и E; три норлигнана – магнатриол B, магнальдегиды D и E; и четыре дилигнана – магнолигнаны F, G, H и 1, а также рандаин, рандайол, синаповый альдегид, сирингарезинол, сирингарезинол 4′-О-β-D-глюкопиранозид и 6′-О-метилхонокиол. Их структуры были определены химическими и спектральными методами.
Позже, в 1999 году, в патенте Университета Техас Систем (University of Texas System) [6] впервые раскрыли синтез и применение анксиолитического соединения дигидрохонокиола, его производных, аналогов и гомологов. Эти соединения были получены полусинтетическим путем из природного продукта хонокиола, содержащегося в магнолии, в одну стадию с использованием гидрирования по Уилкинсону. В другой схеме полный синтез наиболее мощного соединения – дигидрохонокиола-B – был продемонстрирован с помощью реакции кросс-сочетания, катализируемой палладием (реакция Негиши). Также в патенте показана возможности снижения тревожности у млекопитающих с помощью DHH-B.
Исследования дигидрохонокиола-B обнаружили, что он подавляет вызванное аммиаком повышение внутриклеточной концентрации хлорид-ионов в культурах нейронов гиппокампа крыс in vitro и что это действие нечувствительно к бикукуллину, но подавляется TPMPA – селективным антагонистом ГАМК-ρ-рецепторов [7, 8]. Эти результаты предполагают возможную роль ГАМК-рецепторов в защите от потенциально патологического накопления хлорид-ионов в нейронах. Последующие исследования нейротоксичности in vitro, вызванной белком амилоида-β в культурах нейронов гиппокампа, показали, что дигидрохонокиол-B защищает от вызванного амилоидом-β повышения уровня внутриклеточных хлорид-ионов чувствительным к TPMPA образом, что указывает на участие ГАМК-рецепторов [9]. Предполагают, что дигидрохонокиол-B и агонисты ГАМК-рецепторов могут быть одной из терапевтических и/или профилактических стратегий для лечения пациентов с болезнью Альцгеймера. Точная роль ГАМК-рецепторов в нейропротекторном действии дигидрохонокиола-В неясна.
Доклинические исследования
В патенте [6] утверждается, что описанные соединения могут быть полезны при лечении панических атак, острых стрессовых расстройств, тревожных расстройств, связанных с психоактивными веществами, обсессивно-компульсивных расстройств и посттравматических стрессовых расстройств. Было показано, что дигидрохонокиол-В обладает анксиолитическим действием при введении мышам. В одном эксперименте самцам мышей давали однократную дозу хонокиола, дигидрохонокиола, тетрагидрохонокиола или диазепама (для сравнения) перорально в растворе физиологического солевого раствора, содержащего Tween-80. В качестве контроля применялся аналогичный раствор, но без активного компонента. В ходе эксперимента вводили и оценивали несколько различных доз препаратов. Во втором – фиксировали временной ход поведенческих эффектов дигидрохонокиола-В, диазепама и растворителя (в качестве контроля). В третьем – оценивался эффект семи ежедневных пероральных доз хонокиола, дигидрохонокиола-В или тетрагидрохонокиола через двадцать четыре часа после введения последней дозы. Для оценки действия препаратов использовались три теста: «приподнятый плюс лабиринт» (на тревожность), тест на активность и тест на тягу (для оценки мышечной силы).
Результаты экспериментов показали, что дигидрохонокиол обладает мощным анксиолитическим действием после однократного приема в дозе 0,2 мг/кг, максимальный эффект наступает через 3 часа, а продолжительность действия сохраняется до 12 часов после приема [6]. Семь ежедневных пероральных доз дигидрохонокиола-В не усиливали этот анксиолитический эффект. Однократная доза хонокиола вызывала анксиолитический эффект только при очень высокой дозе (20 мг/кг). Разовая доза тетрагидрохонокиола не вызывала анксиолитического эффекта даже при дозе 20 мг/кг. Семь ежедневных пероральных введений хонокиола или тетрагидрохонокиола вызывали анксиолитический эффект. Диазепам в дозе 1 мг/кг оказывал анксиолитическое действие длительностью не более 2 часов, но также увеличивал амбулаторную активность и нарушал мышечную тягу.
Увеличение дозы дигидрохонокиола-В вызывает нарастающий анксиолитический эффект c выраженной линейной дозозависимостью действия [6]. Пероральная доза 0,2 мг/кг дигидрохонокиола-В проявляет значительный анксиолитический эффект через три часа после приема, в то время как более высокая доза в 1 мг/кг вызывает анксиолитическое действие уже через один час. Поскольку в данной серии экспериментов авторы использовали пероральную дозу 0,2 мг/кг, тесты проводились через три часа после приема дигидрохонокиола-В. Двигательная активность не изменялась в зависимости от дозы или времени, за исключением дозы 0,2 мг/кг через три часа после приема.
Продолжительность анксиолитической активности дигидрохонокиола-В после приема внутрь в дозе 0,5 мг/кг длится не менее 12 часов после приема, заканчиваясь между 12 и 24 часами после перорального введения [6]. Между 12 и 24 часами анксиолитическая активность не измерялась. Такая длительная продолжительность действия указывает на возможность применения одной разовой дозы в день. В клинической практике известно, что однократная доза значительно улучшает соблюдение пациентом режима приема. Двигательная активность животных не изменилась.
Бензодиазепиновое соединение, диазепам, было использовано в качестве положительного контроля анксиолитической активности в данной серии тестов из-за его широкого применения и признания в качестве репрезентативного представителя бензодиазепинов [6]. Время пика анксиолитического действия диазепама составляет 0,17 часа (10 мин.). Тесты анксиолитического действия в последующих сериях экспериментов проводились с диазепамом через 10 мин. после перорального приема для получения пиковой реакции. Продолжительность действия диазепама после эффективной дозы 1 мг/кг перорально составляет один час для его анксиолитической активности и 0,17 часа – для влияния на двигательную активность и пагубных эффектов на мышечную тягу (выработка атаксии).
Также оценивалась толерантность после хронического применения, то есть снижение анксиолитической активности, требующее увеличения дозы при длительном применении. Дигидрохонокиол-В и диазепам давали перорально каждый день в течение семи дней, а затем проверяли анксиолитическое действие [6]. Эффективность обоих препаратов не снизилась. Доза каждого соединения после семи дней приема давала такую же анксиолитическую активность, как и после приема одной дозы. Дигидрохонокиол-В по-прежнему не изменял двигательную активность. Диазепам продолжал изменять двигательную активность и уменьшал мышечную тягу.
Исследуя тревожность мышей, дигидрохонокиол-В давали за три часа до тестирования, а диазепам – за 10 минут до начала [6]. Чтобы установить, взаимодействуют ли дигидрохонокиола-В и диазепам, эффективные дозы препаратов вводили отдельным мышам, чтобы показать анксиолитическую активность каждого соединения в отдельности. Затем эффективная доза каждого соединения, введенная в соответствующее время, была объединена. Комбинация дигидрохонокиола-В и диазепама привела к увеличению анксиолитической активности в три раза по сравнению с каждым из этих препаратов по отдельности. Таким образом, соединения действуют синергично как анксиолитики. Эффект диазепама на двигательную активность отменяется при сочетании с дигидрохонокиолом-В, но дигидрохонокиол-В не влиял на атаксию, вызванную диазепамом.
Время нахождения в открытой руке приподнятого крестообразного лабиринта наблюдалось в течение пяти минут [6]. Дигидрохонокиол-В (0,2 мг/кг, перорально) вводили за три часа до тестирования. Диазепам (1 мг/кг, перорально) давали за 10 мин до тестирования. Флумазенил (0,3 мг/кг, подкожно; препарат, блокирующий бензодиазепиновые рецепторы, который при введении блокирует анксиолитическое действие бензодиазепинов) вводился за 10 мин до тестирования. Как оказалось, флумазенил блокирует анксиолитическую активность диазепама, но не блокирует действие дигидрохонокиола-В. Это указывает на то, что дигидрохонокиол-В действует не на том же участке рецептора, что и бензодиазепиновые анксиолитики.
Целью исследования [10] было оценить, развивает ли дигидрохонокиол-B, мощное анксиолитическое соединение, бензодиазепиноподобные побочные эффекты. Доза диазепама 1 мг/кг, почти эквивалентная минимальной дозе для проявления анксиолитического действия, нарушала мышечную тягу, потенцировала сон, вызванный гексобарбиталом, и ухудшала показатели обучения и памяти. Дигидрохонокиол-B, даже в дозе 1 мг/кг (т.е. в пять раз выше минимальной дозы для проявления значительного анксиолитического действия), не развивал диазепамоподобных побочных эффектов и не усиливал побочные эффекты диазепама. Напротив, потенцирование диазепамом сна, вызванного гексобарбиталом, уменьшалось под действием 1 мг/кг дигидрохонокиола-B. Более того, мыши, получавшие 10 ежедневных доз диазепама в дозировке 1 мг/кг и 5 мг/кг дигидрохонокиола-B, проявляли симптомы абстиненции, характеризующиеся гиперреактивностью, тремором и реакцией щелчка хвостом, когда им вводили флумазенил (10 мг/кг, внутривенно). Эти результаты позволяют предположить, что в отличие от бензодиазепинового анксиолитика диазепама, дигидрохонокиол-B с меньшей вероятностью вызовет двигательную дисфункцию, центральную депрессию, амнезию или физическую зависимость при эффективной дозе, необходимой для достижения анксиолитического эффекта.
Сравнительная оценка анксиолитикоподобной активности хонокиола и его производных была проведена в 2000 году [11]. Целью данного исследования было найти аналоги хонокиола, более эффективные при остром введении. Среди восьми исследованных аналогов, дигидрохонокиол-B проявил значительную анксиолитическую активность в дозе 0,04 мг/кг. После перорального приема 1 мг/кг дигидрохонокиол-B анксиолитикоподобная активность была четко выражена через один час и достигла пика через три часа, оставаясь значительной в течение более четырех часов после приема. Совместное применение дигидрохонокиола-B с диазепамом привело к усилению анксиолитикоподобной эффективности. Более того, как и в случае с диазепамом, анксиолитикоподобный эффект аналога снижался флумазенилом. В отличие от этого, бикукуллин, антагонист ГАМК, не влиял на активность дигидрохонокиола-B. В совокупности эти результаты позволяют предположить, что данный аналог хонокиола действует на бензодиазепиновый сайт распознавания комплекса ГАМК/бензодиазепиновый рецептор.
В исследовании [12] было проведено дальнейшее подтверждение анксиолитического эффекта дигидрохонокиола-B с помощью дополнительной поведенческой процедуры (конфликтный тест Фогеля у мышей – противоречие между жаждой и наказанием) и биохимической оценки (определение in vitro стимулированного мусцимолом поглощения 36Cl- в синаптонейросомах коры мыши). Как и в предыдущих экспериментах, дигидрохонокиол-B (0,04–1 мг/кг, перорально) дозозависимым образом продлевал время, проведенное в открытых руках приподнятого лабиринта: 0,008 мг/кг – 6,8 с/5 мин, 0.04 – 12,3, 0,2 – 18,1, 1,0 – 24,9, что аналогично с действием 1 мг/кг диазепама. Контрольный показатель составлял 5,8 с/5 мин. Более того, в тесте конфликта Фогеля дигидрохонокиол-B (5 мг/кг, перорально) значительно увеличивал потребление воды, несмотря на наказание – 17,9 раз/30 мин. против 4,3 в контрольной группе. В тестах с синаптонейросомами коры головного мозга мышей 10 и 30 мкМ дигидрохонокиола-B значительно увеличивали приток 36Cl- в отсутствие мусцимола. В присутствии 25 мкМ мусцимола добавление 1 мкМ дигидрохонокиола-B приводило к значительному усилению поглощения 36Cl- на 113%, а для дальнейшей стимуляции поглощения 36Cl-, вызванного 250 мкМ мусцимола, требовалось 30 мкМ дигидрохонокиола-B. Результаты этих исследований подтверждают, что DHH-B является мощным анксиолитическим агентом и что комплекс Cl-каналов, связанный с рецепторами ГАМК, вовлечен в анксиолитическую эффективность дигидрохонокиола-B.
Потенциал нецелевого использования соединений или метаболитов Magnolia officinalis
Дигидрохонокиол-B не исследован на людях. Однако как само вещество, так и фитопрепараты магнолии доступны в интернет-магазинах как БАД. В работе [13] с помощью изучения ряда веб-сайтов были выявлены три группы злоупотребляющих магнолией: (а) субъекты с психиатрическим анамнезом, уже лечившиеся бензодиазепинами, которых привлекает кора магнолии как «натуральное успокоительное»; (б) лица, злоупотребляющие различными наркотиками, употребляющие магнолию с рядом других трав/растений, которых интересуют ГАМК-ергические/каннабимиметические свойства; (в) субъекты, наивные в отношении злоупотребления наркотиками, но воспринимающие магнолию как натуральную пищевую добавку для контроля веса. Недавний рост популярности магнолии, в основном как седативного средства, может быть обусловлен ее особыми фармакологическими свойствами, приемлемым уровнем доступности, практически повсеместным благоприятным правовым статусом и тягой покупателей к продукту, который воспринимается как «натуральный» и, следовательно, в какой-то степени «безопасный».
Искомые потребителями эффекты включают: снижение уровня тревожности; снотворные эффекты; мягкое антидепрессантное действие; чтобы «расслабиться» без или в сочетании с алкоголем; для использования в качестве более безопасной альтернативы фенибуту; для купирования и облегчения эффекта отмены бензодиазепинов, фенибута, табака, алкоголя, ГБЛ и опиатов; для контроля аппетита и веса; для облегчения тошноты и головных болей.
Рецептурные лекарства, рекреационные препараты и растения, которые, как сообщается, принимаются одновременно в сочетании с соединениями, связанными с магнолией, включают ГАМК-эргики: фенибут; золпидем; ТГК-подобные молекулы: ТГК; синтетические каннабимиметики; когнитивные усилители/ноотропы; растения: Mytragina speciosa (Kratom), Erythrina mulungu (Mulungu), Bacopa, Sceletium tortuosum (Kanna); Rhodiola rosea, и Ashwaghanda;
Способы приема, дозировки и побочные эффекты
Рекомендуемые интернет-продавцами способы приема внутрь, формы и дозировки – капсулы, содержащие по 7,5 мг дигидрохонокиол-B с предлагаемой дозировкой по 1–2 капсулы, которые применяют перорально «по мере необходимости». Описаны дозировки по 600–800 мг экстракта магнолии.
Потребители сообщали о толерантности и побочных эффектах магнолии, ее компонентов или их аналогов: толерантность при частом использовании (более один или два раза в неделю), онемение и/или жжение рта и горла, длительное головокружение, легкий звон в ушах.
Заключение
Дигидрохонокиол-B показал себя в экспериментах на животных как эффективный анксиолитик, сопоставимый по мощности с представителями бензодиазепинового ряда, но не проявляющий опасных побочных эффектов. Однако на людях дигидрохонокиол-B не исследован, хотя и продается как БАД.
Вопрос неправильного использования продуктов магнолии, ее биологически активных компонентов, их аналогов или производных может быть причиной для беспокойства. Потребители не полностью осведомлены о фармакологической активности и возможных медицинских последствиях приема неизученных соединений, безопасность которых для человека не установлена. Кроме того, злоупотребление продуктами Magnolia часто происходит в контексте полинаркотического приема, а фармакодинамика и фармакокинетика взаимодействия дигидрохонокиола-B с другими веществами неизвестна. Как и в случае с любым психоактивным препаратом, врачи должны тщательно оценивать пациентов на предмет наличия в анамнезе злоупотребления наркотиками и наблюдать их на наличие признаков злоупотребления любыми препаратами, включая кору магнолии или синтетические аналоги ее компонентов.
1. Mohammadi, M.R., Pourdehghan, P., Mostafavi, S.-A., Hooshyari, Z., Ahmadi, N., Khaleghi, A., Generalized anxiety disorder: Prevalence, predictors, and comorbidity in children and adolescents. Journal of Anxiety Disorders, 2020. 73: p. 102234. DOI: https://doi.org/10.1016/j.janxdis.2020.102234.
2. Salari, M., Etemadifar, M., Gharagozli, K., Etemad, K., Ashrafi, F., Ashourizadeh, H., Incidence of anxiety in epilepsy during coronavirus disease (COVID-19) pandemic. Epilepsy & Behavior, 2020. 112: p. 107442. DOI: https://doi.org/10.1016/j.yebeh.2020.107442.
3. Kubota, M., The therapeutic effects of saiboku-to anxiety disorder and others. Journal of Traditional Sino-Japanese Medicine, 1996. 17: p. 183-186.
4. Niu, L., Hou, Y., Jiang, M., Bai, G., The rich pharmacological activities of Magnolia officinalis and secondary effects based on significant intestinal contributions. Journal of Ethnopharmacology, 2021: p. 114524.
5. Yahara, S., Nishiyori, T., Kohda, A., Nohara, T., Nishioka, I., Isolation and Characterization of Phenolic Compounds from Magnoliae Cortex Produced in China. Chemical & Pharmaceutical Bulletin, 1991. 39(8): p. 2024-2036. DOI: 10.1248/cpb.39.2024.
6. WO 1999000346 A1, 1999.
7. Irie, T., Miyamoto, E., Kitagawa, K., Maruyama, Y., Inoue, K., Inagaki, C., An anxiolytic agent, dihydrohonokiol-B, inhibits ammonia-induced increases in the intracellular Cl− of cultured rat hippocampal neurons via GABAC receptors. Neuroscience letters, 2001. 312(2): p. 121-123.
8. Johnston, G.A.R., Hanrahan, J.R., Chebib, M., Duke, R.K., Mewett, K.N., Modulation of ionotropic GABA receptors by natural products of plant origin. Advances in pharmacology, 2006. 54: p. 285-316.
9. Liu, B., Hattori, N., Zhang, N.-Y., Wu, B., Yang, L., Kitagawa, K., Xiong, Z.-M., Irie, T., Inagaki, C., Anxiolytic agent, dihydrohonokiol-B, recovers amyloid β protein-induced neurotoxicity in cultured rat hippocampal neurons. Neuroscience letters, 2005. 384(1-2): p. 44-47.
10. Kuribara, H., Kishi, E., Maruyama, Y., Does dihydrohonokiol, a potent anxiolytic compound, result in the development of benzodiazepine-like side effects? Journal of pharmacy and pharmacology, 2000. 52(8): p. 1017-1022.
11. Kuribara, H., Kishi, E., Kimura, M., Weintraub, S.T., Maruyama, Y., Comparative assessment of the anxiolytic-like activities of honokiol and derivatives. Pharmacology Biochemistry and Behavior, 2000. 67(3): p. 597-601. DOI: https://doi.org/10.1016/S0091-3057(00)00401-9.
12. Maruyama, Y., Kuribara, H., Kishi, E., Weintraub, S.T., Ito, Y., Confirmation of the anxiolytic‐like effect of dihydrohonokiol following behavioural and biochemical assessments. Journal of pharmacy and pharmacology, 2001. 53(5): p. 721-725.
13. Schifano, F., Guarino, V., Papanti, D.G., Baccarin, J., Orsolini, L., Corkery, J.M., Is there a potential of misuse for Magnolia officinalis compounds/metabolites? Human Psychopharmacology: Clinical and Experimental, 2017. 32(3): p. e2595.