Уролитин А – естественный метаболит, образующийся в кишечнике человека из полифенолов, содержащихся в гранате, орехах и других растительных продуктах. Стимулирование аутофагии и митофагии уролитином А делает его перспективной молекулой для увеличения человеческого долголетия. В животных моделях болезни Альцгеймера показаны нейропротекторные эффекты препарата и его предшественника – гранатового сока, а такие увеличение продолжительности жизни, положительное действие на мышцы, сердечно-сосудистую систему и кишечник. Потенциал уролитина А для применения у людей еще недостаточно изучен. В обзоре рассмотрены результаты доклинических и клинических исследований уролитина А и гранатового сока или экстракта.
Общая характеристика
Уролитин А (Urolithin A, UAS03, UroA, 3,8-Dihydroxyurolithin; 3,8-дигидрокси-6H-дибензо[b,d]пиран-6-он; C13H8O4; CAS 1143-70-0)
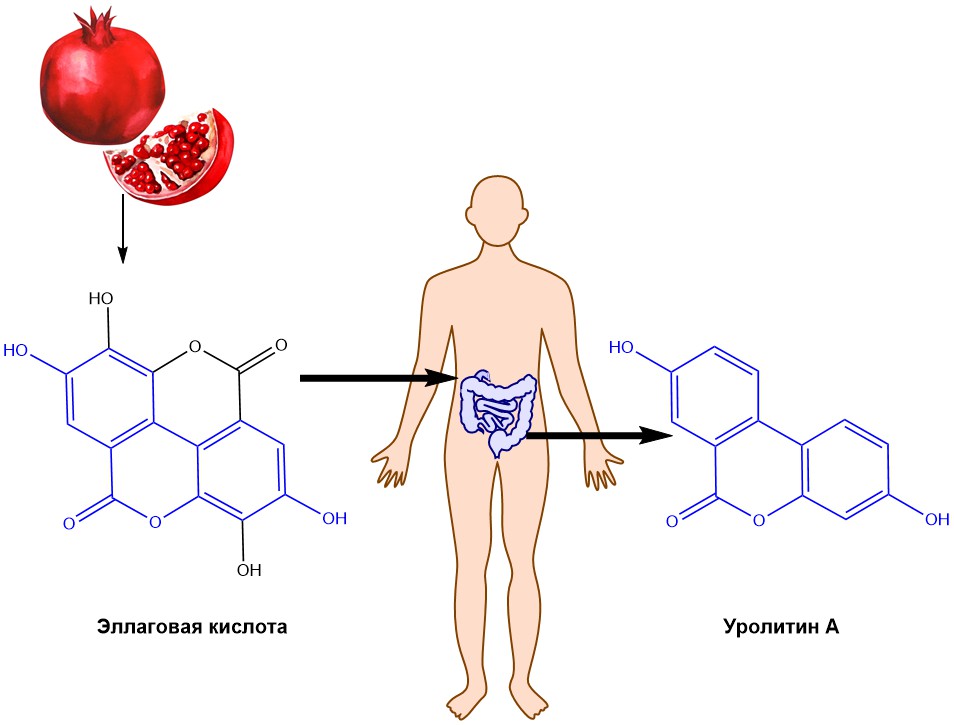
Рисунок 1 – Образование уролитин А под действием микробиома кишечника
Гранаты (Punica) содержат природные полифенолы, включая эллагитаннины, которые гидролизуются до эллаговой кислоты. Эллаговая кислота преобразуется микробиотой (син. микробиом) кишечника в уролитины. Микробиом кишечника включает совокупность микроорганизмов, бактерий, вирусов, простейших и грибов, обитающих в желудочно-кишечном тракте. Различные исследования преимущественно изучали антиоксидантные эффекты уролитина, но более интересным с точки зрения старения является то, что уролитин А, как недавно сообщалось в научных публикациях, вызывает аутофагию (естественное разрушение клеткой ненужных или их поврежденных компонентов) и митофагию (разрушение митохондрий при аутофагии). Улучшение здоровья митохондрий обусловлено селективной очисткой и утилизацией дисфункциональных митохондрий. Митофагия нарушается с возрастом и при некоторых старческих заболеваниях. Восстановление правильного функционирования митофагии считается перспективной стратегией противодействия возрастному снижению работоспособности органов. Кроме того, митофагия улучшает качество клеточного пула митохондрий и тесно связана с генерацией новых органелл, что приводит к улучшению митохондриальной дыхательной способности. Поскольку уролитин А еще находится на ранней стадии разработки, в данном обзоре также будут рассмотрены исследования с использованием экстракта граната.
Уролитин А принадлежит к семейству уролитинов, характеризующихся химической структурой, содержащей α-бензо-кумариновый каркас (Рис. 1). Уролитины образуются в толстой кишке после опосредованной микробиомом трансформации природных полифенолов, которые содержатся в диетических продуктах, таких как гранаты, клубника, малина и грецкие орехи [1].
Впервые уролитиновые метаболиты были обнаружены у крыс в 1980 году [2]. Позже результаты экспериментов подтвердили, что аналогичное преобразование происходит в микробиоме кишечника у многих видов, включая насекомых, червей и млекопитающих. Исследование 2005 года также показало образование уролитин А из эллаговой кислоты микробиотой кишечника человека [3], что делает его наиболее распространенным типом уролитина, производимым естественным образом. Затем в клинических исследованиях было проведено измерение содержания уролитин А в плазме крови человека после употребления граната, ягод и орехов.
Интересно, что трансформация пищевых предшественников в уролитин А наблюдается не у всех людей. Каждый человек по-разному метаболизирует компоненты граната. В работе 2018 года определили три различных типа метаболизма уролитина (UM): метаботип UM-В (субъекты, которые производят изоуролитин А и/или уролитин В, а также уролитин А), UM-А (выделяют только уролитин А) и UM-0 (уролитины вообще не вырабатываются) [4]. В исследовании людей с избыточным весом [5] обнаружили, что у лиц с UM-В концентрации биомаркеров сердечно-сосудистого риска (LDL-c, apoB, oxLDL-c и т.д.) были выше, чем у людей с UM-А и UM-0, и только с UM-В наблюдалось улучшение этих биомаркеров при употреблении экстракта граната в течение трех недель. Неясно, связано ли это с уролитинами как таковым, или же с тем, что у лиц с UM-В биомаркеры ССЗ изначально были хуже.
В другом исследовании 2018 года [4] обнаружили, что основным фактором, определяющим метаботип уролитина является возраст, а не пол или индекс массы тела. При этом, метаботип UM-A наиболее выражен в молодом возрасте, а склонность к UM-B увеличивался с течением времени. Предполагают, что различия между индивидами в метаботипе уролитина могут объяснить неудачи испытаний экстракта граната на людях. В связи с этим уровень уролитинов в плазме крови после употребления экстракта граната оказывается различным у разных людей. В одном из исследований сообщалось, что у людей, принявших 180 мл гранатового сока (25 мг эгалловой кислоты, 318 мг эллагитаннинов), через один час после приема в плазме крови определялось 31,9 нг/мл эллаговой кислоты, которая выводилась через четыре часа [6]. Таким образом, в исследованиях с использованием экстракта или сока граната к двум важным выводам: 1) люди могут по-разному метаболизировать гранат, и 2) гранатовый сок содержит много других соединений (например, различные полифенолы). Процесс выработки уролитинов непостоянен и наблюдается только примерно у 40% пожилых людей. Для того чтобы стать «производителем уролитина А», необходим соответствующий микробиом кишечника, который зависит от возраста, состояния здоровья и рациона питания.
Биодоступность уролитинов при пероральном приеме умеренная, поэтому в настоящее время компания Amazentis разрабатывает форму уролитина А с повышенной биодоступностью [7]. Еще одним производителем уролитинов А и B с 2021 года стала китайская фармацевтическая компания Cofttek Holding Limited [8].
Доклинические исследования
Нейропротекторное действие
Данные свидетельствуют о том, что гранат может быть полезен в животных моделях болезни Альцгеймера; однако более интересен потенциал уролитина А в отношении аутофагии и митофагии. Всего проведено семь доклинических исследований с использованием экстракта граната. Исследования на людях, направленных на профилактику деменции, предотвращение ухудшения или на улучшение когнитивных функций, с использованием граната или уролитина не проводились.
В ходе лабораторных и клинических исследований были выявлены некоторые механизмы нейропротекторного действия. В статье [9] авторы опубликовали вычислительные работы in silico для оценки потенциала различных компонентов экстракта граната и уролитинов преодолевать гематоэнцефалический барьер (ГЭБ). Было предсказано, что ни одно из соединений, содержащихся в гранате, не пересекает ГЭБ. Однако расчеты показали, что уролитины A и B (и их метилированное производное) проникают через ГЭБ. Уролитин А также уменьшал фибриллизацию Aβ in vitro и улучшал выживаемость в модели болезни Альцгеймера на червях.
Краткосрочное лечение экстрактом граната в течение трех недели старых мышей с болезнью Альцгеймера снижало уровень Aβ42, но не изменяло познавательные способности [10]. Более длительное применение экстракта на молодых или старых мышах с болезнью Альцгеймера уменьшило количество амилоидных бляшек, окислительный стресс, воспаление (TNFα и другие цитокины, микроглиоз, но не астроглиоз) и увеличило плотность синапсов, BDNF, аутофагию и улучшило когнитивные показатели [11-16]. Проведены исследования по влиянию уролитина на старение, продолжительность жизни и ССЗ в модельных организмах, а также на нейропатию у грызунов.
На крысиной модели нейропатии, вызванной перерезанием большеберцового и икроножного нервов, 24-дневное лечение стандартизированным экстрактом плодов граната (Punica granatum L.), содержащим 41,6% эллаговой кислоты, 10% пуникалагинов и 5,1% гранатина, ослабило невропатическую боль, снизило уровень TNFα, повысило концентрации глутатиона и нитрита [17].
Продолжительность жизни и старение
Исследования in vitro на линиях клеток мышиных макрофагов J774.1 и HEK (клетки почки эмбриона человека) показывают, что уролитин А предотвращает активацию макрофагов, для чего требуется эффективная аутофагия [18].
Уролитин А увеличил продолжительность жизни круглых червей Caenorhabditis elegans на 45%, хотя при использовании эллаговой кислоты такого действия не наблюдалось. Препарат повышал активность червей (например, работу фарингеального насоса) и улучшал организацию мышечных волокон. Продление жизни зависело от функции митохондрий и митофагии. Интересно, что уролитин А понижал содержание митохондрий у молодых червей, сохраняя при этом максимальную дыхательную способность, и увеличивал количество митохондрий у старых особей. В двух линиях клеток млекопитающих (мышцы и кишечник) уролитин А также индуцировал аутофагию. Добавка граната в корм для плодовых мушек увеличила продолжительность жизни самцов и самок на 18% и 8%, соответственно [19].
Никотинамид рибозид (Nicotinamide riboside) – стимулятор НАД+
Шестинедельное лечение старых мышей, которым вводили уролитин А 50 мг/кг в день в течение восьми месяцев, увеличило беговую выносливость на 42%, в то время как введение уролитина А молодым мышам повышало выносливость на 65%. Хроническое введение уролитина А не повлияло на увеличение массы тела или эволюцию жировой и безжировой массы тела. Несмотря на отсутствие изменений в мышечной массе, сила хвата увеличилась на 9% и на 57% – уровень спонтанной физической нагрузки, измеренной с помощью бегового колеса. Это позволяет предположить, что выявленные преимущества после применения препарата были, в первую очередь, связаны с эффективностью работы мышц [20].
Дистрофия мышц
Мышечная дистрофия Дюшенна (МДД) является наиболее распространенной мышечной дистрофией, и, несмотря на достижения в области генетических и фармакологических методов лечения, лечение этой болезни остается серьезной проблемой. Митохондриальная дисфункция способствует развитию МДД, однако механизмы, с помощью которых это происходит, остаются неустановленными. Данные на экспериментальных моделях и на образцах тканей пациентов с МДД ex vivo показывают, что снижение экспрессии генов, участвующих в митохондриальной аутофагии или митофагии, способствует митохондриальной дисфункции [21]. Маркеры митофагии снижены в скелетных мышцах и в мышечных стволовых клетках (MuSCs) мышиной модели МДД. Введение активатора митофагии – уролитина А в дозе 50 пг/день в течение 10 недель – восстановило митофагию у червей и мышей с МДД и в первичных миобластах пациентов с МДД ex vivo, повысив ее в ~3,5 раза от контрольного группы. Также улучшилисьдыхательная способность скелетных мышц и регенеративная функция MuSCs, что привело к восстановлению работоспособности мышц и повышению выживаемости в мышиных моделях МДД. Эти данные показывают, что восстановление митофагии облегчает симптомы МДД, и предполагают, что уролитин А может найти потенциальное терапевтическое применение при мышечных дистрофиях.
Сердечно-сосудистые заболевания
В крысиной модели повреждения аорты на диете с высоким содержанием холестерина 12-недельное лечение уролитином А по 3 мг/кг в день снизило уровень ЛПНП, снизило уровень ангиотензина II, повысило активность Nrf2 и улучшило морфологию стенок аорты [22]. В крысиной модели стрептозотоцин-индуцированного диабета 1 типа, трехнедельное лечение уролитином A и B по 2,5 мг/кг в день в течение трех недель улучшило сердечную функцию (максимальная скорость давления в желудочках, уменьшенное время сокращения, сократимость кардиомиоцитов и т.д.) [23]. Применение уролитинов in vivo снижало примерно на 30% экспрессию провоспалительного цитокина фракталкина в миокарде, предотвращая ранний воспалительный ответ сердечных клеток на гипергликемию. Улучшение микроокружения миокарда имело функциональное проявление, о чем свидетельствует увеличение максимальной скорости повышения давления в желудочках по сравнению с диабетической группой (+18% и +31% у крыс, леченных уролитином А и Б, соответственно), а также параллельное уменьшение времени изоволюмического сокращения (-12%). В соответствии с гемодинамическими данными, оба уролитина вызывали восстановление сократимости кардиомиоцитов и динамики кальция, что привело к увеличению скорости повторного растяжения (в среднем +21%), уменьшению времени повторного растяжения (-56%) и более эффективному удалению цитозольного кальция (-32%). В модели ишемии/реперфузии уролитин А снижал гибель клеток и размер инфаркта, улучшал сердечную функцию и уменьшал концентрацию активных форм кислорода. Эти эффекты были опосредованы через путь PI3K/Akt [24].
Экстракт граната в многочисленных мышиных моделях атеросклероза уменьшал размер атеросклеротических бляшек до 44% и долю окклюзионных бляшек коронарных артерий. Экстракт также снижал уровни окислительного стресса, окси-ЛПНП (окисленные липопротеины низкой плотности), MCP-1 (который рекрутирует макрофаги в бляшки), накопления липидов, макрофагальной инфильтрации и фиброза в миокарде, а также увеличивал эффлюкс холестерина макрофагами [25-27]. Исследования in vitro показывают, что комбинация уролитина А и уролитина В повышает уровень нитритов/нитратов и эндотелиальной NO-синтазы, но не оказывает никакого эффекта по отдельности [28]. В эндотелиальных клетках артерий человека, подвергшихся воздействию окси-ЛПНП, уролитин А повышал выживаемость клеток, увеличивал экспрессию NO и эндотелиальной NO-синтазы, а также снижал экспрессию воспалительных белков [29].
Улучшение целостности кишечного барьера
Важность микробиоты кишечника для здоровья и патофизиологии человека неоспорима. Несмотря на обилие данных метагеномики, функциональная динамика микробиоты кишечника у здорового и больного человека остается малоизученной. Уролитин А, основной микробный метаболит, образующийся из полифенольных веществ ягод и плодов граната, обладает противовоспалительной, антиокислительной и антивозрастной активностью. В работе [30] исследователи на мышиной модели колита, вызванного 2,4,6-тринитробензолсульфоновой кислотой или декстрансульфатом, показали, что уролитин А и его синтетический аналог UAS03 с восстановленной до CH2 карбонильной группой в дозе по 20 мг/кг каждые 12 часов в течение 60 часов значительно улучшают барьерную функцию кишечника и подавляют воспаление. Концентрации маркеров воспаления у обработанных уролитином А мышей снижались на ~30–50%, а длина кишечника сохранялась на уровне до 70% от таковой у интактных животных. Уролитин А и UAS03 выполняют барьерные функции через активацию арил-углеводородных рецепторов (AhR) и Nrf2-зависимых путей, повышая уровни эпителиальных белков плотного соединения. Важно отметить, что лечение этими соединениями в доклинических моделях ослабляло колит путем устранения барьерной дисфункции и благодаря противовоспалительной активности.
Клинические исследования
Исследования на животных показывают пользу граната, но результаты на людях неоднозначны. Уролитин А изучался в двух типах клинических исследований: 1) ассоциативные исследования, в которых испытуемые получали пищевой источник с предшественниками уролитина (например, гранатовый сок или экстракт) и впоследствии оценивали профиль производства уролитина, и 2) интервенционные клинические исследования, в которых люди непосредственно получали уролитин А путем перорального приема. Потенциал уролитина А в организме человека еще предстоит выяснить.
Дистрофия мышц
В исследовании фазы 1, проведенном на 60 добровольцах, у пожилых людей 28-дневный прием уролитина А по 250–2000 мг/день стимулировал аутофагию, улучшал функцию митохондрий и окисление жирных кислот в скелетных мышцах человека, как отмечено в презентации компании Amazentis на конференции [7]. Некоторые результаты исследования раскрыты в статье 2019 года [31]. Уролитин А являлся биологически доступным в плазме крови во всех испытанных дозах. Мешающего эффекта приема пищи, когда препарат вводился в пищевой матрице с высокобелковым йогуртом не наблюдалось. Период полураспада составил 17–22 часа, скорее всего, из-за активной энтерогепатической рециркуляции. Уролитин А присутствовал в плазме, как в виде исходного соединения, так и в виде глюкуронида и конъюгированных сульфонированных форм. В тканях скелетных мышц препарат в основном присутствовал в своей неизмененной форме. Концентрации маркеров окисления жирных кислот на фоне приема 1000 мг уролитина А увеличились в 2,5 (CPT1B) раза и в примерно в 10 раз (FABP3), как и маркеров митохондриального биогенеза и аутофагии – до трехкратного от исходного уровня. Уролитин А повысил экспрессию набора генов GO_MITOCHONDRION в скелетной мышце латерального валика испытуемых после приема в дозе 500 или 1000 мг в течение 28 дней по сравнению с плацебо и в той же мышце сидячих или активных здоровых пожилых людей. Таким образом, препарат может быть полезен при лечении возрастной дистрофии мышц.
Сердечно-сосудистые заболевания
По данным метаанализа восьми рандомизированных контролируемых исследований (РКИ) было обнаружено, что потребление гранатового сока в дозах от 50 до 300 мл/день снижает систолическое артериальное давление (-5 мм рт. ст.) и диастолическое артериальное давление (-2 мм рт. ст.) [32]. Независимо от продолжительности исследования (больше или меньше 12 недель) или дозы, снижение систолического давления было значительным, а диастолического – незначительным при высоких и низких дозах [33].
В другом метаанализе двенадцати РКИ сообщили, что гранатовый сок не изменил уровень ЛПНП или ЛПВП, но снизил содержание триглицеридов. Два замечания к вышеупомянутым исследованиям заключаются в том, что гранатовый сок содержит много других соединений, а люди, как отмечено выше, по-разному метаболизируют эллаговую кислоту. Таким образом, эти исследования могут не иметь отношения к уролитину А, а их результаты находятся под влиянием других биологически активных компонентов граната. Неоднозначные результаты также отражены в двух метаанализах, показавших отсутствие пользы гранатового сока для контроля уровня глюкозы или С-реактивного белка [34, 35].
Черепно-мозговая травма у младенцев
Исследования на животных продемонстрировали терапевтический потенциал гранатового сока, богатого полифенолами. Сообщалось об изменении микроструктуры белого вещества и функциональных связей в головном мозге младенцев после внутриутробного воздействия гранатового сока при беременности свнутриутробным ограничением роста (ВУОР). В двойном слепом рандомизированном контролируемом исследовании проведено изучение влияния употребления гранатового сока матерью на структуру мозга и повреждения во второй когорте беременных с ВУОР, диагностированным на сроке 24–34 недели беременности (NCT04394910) [36]. Девяносто девять матерей и их соответствующие требованиям плоды (n=103) были рандомизированы на прием 8 унций (~237 мл) гранатового сока (n=56) или плацебо (n=47), которые должны были употребляться ежедневно с момента поступления и до родов. Подгруппа участников прошла эхокардиограмму плода после двух недель приема сока и 57 младенцев (n=26 из группы приема гранатового сока, n=31 – плацебо) прошли МРТ для оценки повреждения мозга, объемов и диффузии белого вещества. Значительных различий между группами в объемах мозга или микроструктуре белого вещества обнаружено не было. Однако младенцы, матери которых употребляли гранатовый сок, продемонстрировали пониженный, по сравнению с плацебо, риск повреждения мозга, включая любое повреждение белого или серого вещества коры головного мозга. Эти предварительные результаты свидетельствуют о том, что гранатовый сок может служить безопасным внутриутробным нейропротектором при беременности, осложненной ВУОР, что требует дальнейшего изучения.
Рак предстательной железы
Гранат также был протестирован в клинических испытаниях при раке простаты. В исследовании с участием 183 человек после первичной терапии рака простаты экстракт граната (доза не указана) не увеличивал время удвоения простатоспецифическогой антигена (ПСА) [37]. Однако в подгруппе пациентов с генотипом AA супероксиддисмутазы марганца (MnSOD) (что может указывать на низкий антиоксидантный статус) время удвоения ПСА увеличилось на 12 месяцев в группе приема граната по сравнению с 1,8 месяцами в группе плацебо. Однако количество пациентов с генотипом MnSOD AA было небольшим.
Дозировка, побочные эффекты и безопасность
Уролитин А находится в стадии разработки и не является одобренным препаратом. Экстракт граната доступен в магазинах, продающих биологически активные добавки. Гранаты и гранатовый сок – популярные пищевые продукты.
Долгосрочная безопасность добавок с уролитином А и гранатом неизвестна, но краткосрочное лечение экстрактом граната безопасно. Исследования компании Amazentis показали, что уролитин А безопасен в дозировке 250–2000 мг в течение 28 дней.
В клинических исследованиях экстракт граната оказался безопасен. Высокие дозы (3000 мг/день в течение 28 дней) усиливали диарею. Однако крупномасштабные долгосрочные исследования не проводились [38].
Учитывая эту информацию, уролитин А, вероятно, безопасен, однако это следует подтвердить в будущих исследованиях.
Информации о лекарственном взаимодействии с уролитином А не известно. Однако гранатовый сок взаимодействует с цитохромом Р450, который отвечает за разрушение ксенобиотиков в организме, и, таким образом, может вызывать побочные эффекты, обусловленные приемом других препаратов [38]. Стоит учитывать, что уролитин А присутствует в моче до 48 часов после употребления гранатового сока.
Что касается дозировки, уролитин А в различных исследованиях тестируют в дозах 250–2000 мг/день. В большинстве экспериментов с гранатовым соком использовалось 250–500 мл/день (или 500–1000 мг/день экстракта граната).
Заключение
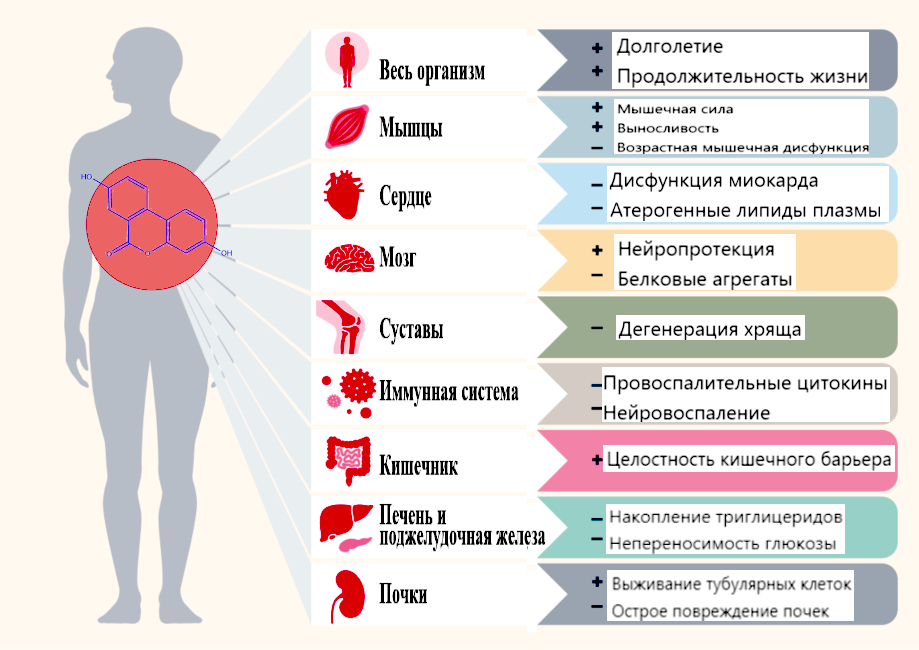
Рисунок 2 – Потенциальные полезные эффекты уролитина А
В данном обзоре на широком спектре in vivo моделей рассмотрены полезные свойства пищевого естественного метаболита – уролитина А. Результаты показывают, что препарат может быть способствовать улучшению здоровья при старении и некоторых хронических заболеваниях (Рис. 2). Важно отметить, что уролитин А защищает от физиологического упадка, что подтверждается восстановлением мышечной функции у молодых животных и предотвращением возрастной дистрофии мышц у старых мышей.
Повышенный интерес к использованию пищевых добавок с уролитином А или экстрактом граната для содействия здоровому старению поддерживается двумя ключевыми факторами. Во-первых, возраст может снизить естественную способность производить уролитин А из его пищевых предшественников. Во-вторых, людям необходим определенный состав микробиома кишечника для такого преобразования, а этот процесс изменчив и протекает только приблизительно у 40% пожилых людей. Примечательно, что дисбактериоз кишечника является общей чертой нескольких возрастных заболеваний и может способствовать ухудшению выработки уролитин А.
Действие уролитина А при старении и возрастных заболеваниях опосредовано активацией митофагии, улучшением функции митохондрий и уменьшением воспаления, что, скорее всего, также связано с его влиянием на функцию митохондрий. Для уролитина А также предложены и другие механизмы действия, связанные с антиокислительным ответом и ингибированием регуляторов пролиферации раковых клеток. Вклад этих механизмов в положительное влияние уролитина А на старение требует дальнейшего изучения. Вполне вероятно, что уролитин А влияет на различные пути в зависимости от конкретного органа и условий. Кроме того, в экспериментах, описанных в данном обзоре, часто используются различные режимы дозирования и пути введения. При планировании будущих исследований уролитина А необходимо учитывать эту вариабельность.
С медицинской точки зрения, действие уролитина А на человека изучено слабо. Клиническое исследование фазы 1 подтвердило активацию митохондриальных биомаркеров в мышцах и плазме крови, как это было показано ранее в клетках и in vivo в модельных организмах. Исходя из этих данных, есть веские основания для изучения влияния уролитина А на состояния, связанные с митохондриальной и мышечной дисфункцией. К ним относятся возрастные патологии с сильным митохондриальным компонентом, такие как мышечное истощение и снижение когнитивных функций, а также заболевания, включая митохондриальные болезни и мышечные дистрофии.
Растущее число литературных данных свидетельствует о благотворном влиянии уролитина А, природного соединения с доказанной биологической безопасностью, на здоровое старение. Эти данные поддерживают использование уролитина А, гранатового сока или экстракта в качестве пищевых добавок у людей для улучшения функции митохондрий и здоровья организма в процессе старения. Однако эти результаты также требуют дальнейших исследований для выявления терапевтического потенциала уролитина А.
Реверол, Рекардин и другие лиганды рецептора REV-ERB. При дистрофии и для регенерации мышц
1. D’Amico, D., Andreux, P.A., Valdés, P., Singh, A., Rinsch, C., Auwerx, J., Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, 2021. 27(7): p. 687-699. DOI: https://doi.org/10.1016/j.molmed.2021.04.009.
2. Doyle, B., Griffiths, L.A., The metabolism of ellagic acid in the rat. Xenobiotica, 1980. 10(4): p. 247-256. DOI: 10.3109/00498258009033752.
3. Cerdá, B., Periago, P., Espín, J.C., Tomás-Barberán, F.A., Identification of Urolithin A as a Metabolite Produced by Human Colon Microflora from Ellagic Acid and Related Compounds. Journal of Agricultural and Food Chemistry, 2005. 53(14): p. 5571-5576. DOI: 10.1021/jf050384i.
4. Cortés-Martín, A., García-Villalba, R., González-Sarrías, A., Romo-Vaquero, M., Loria-Kohen, V., Ramírez-de-Molina, A., Tomás-Barberán, F.A., Selma, M.V., Espín, J.C., The gut microbiota urolithin metabotypes revisited: the human metabolism of ellagic acid is mainly determined by aging. Food & function, 2018. 9(8): p. 4100-4106. DOI: 10.1039/c8fo00956b.
5. González-Sarrías, A., García-Villalba, R., Romo-Vaquero, M., Alasalvar, C., Örem, A., Zafrilla, P., Tomás-Barberán, F.A., Selma, M.V., Espín, J.C., Clustering according to urolithin metabotype explains the interindividual variability in the improvement of cardiovascular risk biomarkers in overweight-obese individuals consuming pomegranate: A randomized clinical trial. Molecular Nutrition & Food Research, 2017. 61(5): p. 1600830. DOI: https://doi.org/10.1002/mnfr.201600830.
6. Seeram, N.P., Lee, R., Heber, D., Bioavailability of ellagic acid in human plasma after consumption of ellagitannins from pomegranate (Punica granatum L.) juice. Clinica Chimica Acta, 2004. 348(1): p. 63-68. DOI: https://doi.org/10.1016/j.cccn.2004.04.029.
7. Amazentis SA. 2021; Available from: https://www.amazentis.com/.
8. Cofttek Holding Limited. 2021; Available from: https://www.cofttek.com/.
9. Yuan, T., Ma, H., Liu, W., Niesen, D.B., Shah, N., Crews, R., Rose, K.N., Vattem, D.A., Seeram, N.P., Pomegranate’s Neuroprotective Effects against Alzheimer’s Disease Are Mediated by Urolithins, Its Ellagitannin-Gut Microbial Derived Metabolites. ACS Chemical Neuroscience, 2016. 7(1): p. 26-33. DOI: 10.1021/acschemneuro.5b00260.
10. Ahmed, A., H. , Subaiea, G., M. , Eid, A., Li, L., Seeram, N., P. , Zawia, N., H. , Pomegranate Extract Modulates Processing of Amyloid-β Precursor Protein in an Aged Alzheimer`s Disease Animal Model. Current Alzheimer Research, 2014. 11(9): p. 834-843. DOI: http://dx.doi.org/10.2174/1567205011666141001115348.
11. Hartman, R.E., Shah, A., Fagan, A.M., Schwetye, K.E., Parsadanian, M., Schulman, R.N., Finn, M.B., Holtzman, D.M., Pomegranate juice decreases amyloid load and improves behavior in a mouse model of Alzheimer’s disease. Neurobiology of Disease, 2006. 24(3): p. 506-515. DOI: https://doi.org/10.1016/j.nbd.2006.08.006.
12. Choi, S.J., Lee, J.-H., Heo, H.J., Cho, H.Y., Kim, H.K., Kim, C.-J., Kim, M.O., Suh, S.H., Shin, D.-H., Punica granatum Protects Against Oxidative Stress in PC12 Cells and Oxidative Stress-Induced Alzheimer’s Symptoms in Mice. Journal of Medicinal Food, 2011. 14(7-8): p. 695-701. DOI: 10.1089/jmf.2010.1452.
13. Rojanathammanee, L., Puig, K.L., Combs, C.K., Pomegranate polyphenols and extract inhibit nuclear factor of activated T-cell activity and microglial activation in vitro and in a transgenic mouse model of Alzheimer disease. J Nutr, 2013. 143(5): p. 597-605. DOI: 10.3945/jn.112.169516.
14. Subash, S., Essa, M.M., Al-Asmi, A., Al-Adawi, S., Vaishnav, R., Braidy, N., Manivasagam, T., Guillemin, G.J., Pomegranate from Oman Alleviates the Brain Oxidative Damage in Transgenic Mouse Model of Alzheimer’s disease. J Tradit Complement Med, 2014. 4(4): p. 232-238. DOI: 10.4103/2225-4110.139107.
15. Essa, M.M., Subash, S., Akbar, M., Al-Adawi, S., Guillemin, G.J., Long-term dietary supplementation of pomegranates, figs and dates alleviate neuroinflammation in a transgenic mouse model of Alzheimer’s disease. PloS one, 2015. 10(3): p. e0120964-e0120964. DOI: 10.1371/journal.pone.0120964.
16. Braidy, N., Essa, M.M., Poljak, A., Selvaraju, S., Al-Adawi, S., Manivasagm, T., Thenmozhi, A.J., Ooi, L., Sachdev, P., Guillemin, G.J., Consumption of pomegranates improves synaptic function in a transgenic mice model of Alzheimer’s disease. Oncotarget, 2016. 7(40): p. 64589-64604. DOI: 10.18632/oncotarget.10905.
17. Jain, V., Pareek, A., Bhardwaj, Y.R., Singh, N., Attenuating effect of standardized fruit extract of Punica granatum L in rat model of tibial and sural nerve transection induced neuropathic pain. BMC Complement Altern Med, 2013. 13: p. 274-274. DOI: 10.1186/1472-6882-13-274.
18. Boakye, Y.D., Groyer, L., Heiss, E.H., An increased autophagic flux contributes to the anti-inflammatory potential of urolithin A in macrophages. Biochimica et Biophysica Acta (BBA) — General Subjects, 2018. 1862(1): p. 61-70. DOI: https://doi.org/10.1016/j.bbagen.2017.10.006.
19. Balasubramani, S.P., Mohan, J., Chatterjee, A., Patnaik, E., Kukkupuni, S.K., Nongthomba, U., Venkatasubramanian, P., Pomegranate Juice Enhances Healthy Lifespan in Drosophila melanogaster: An Exploratory Study. Front Public Health, 2014. 2: p. 245-245. DOI: 10.3389/fpubh.2014.00245.
20. Ryu, D., Mouchiroud, L., Andreux, P.A., Katsyuba, E., Moullan, N., Nicolet-Dit-Félix, A.A., Williams, E.G., Jha, P., Lo Sasso, G., Huzard, D., Aebischer, P., Sandi, C., Rinsch, C., Auwerx, J., Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents. Nat Med, 2016. 22(8): p. 879-888. DOI: 10.1038/nm.4132.
21. Luan, P., D’Amico, D., Andreux, P.A., Laurila, P.-P., Wohlwend, M., Li, H., Imamura de Lima, T., Place, N., Rinsch, C., Zanou, N., Auwerx, J., Urolithin A improves muscle function by inducing mitophagy in muscular dystrophy. Sci Transl Med, 2021. 13(588). DOI: 10.1126/scitranslmed.abb0319.
22. Cui, G.H., Chen, W.Q., Shen, Z.Y., Urolithin A shows anti-atherosclerotic activity via activation of class B scavenger receptor and activation of Nef2 signaling pathway. Pharmacological reports : PR, 2018. 70(3): p. 519-524. DOI: 10.1016/j.pharep.2017.04.020.
23. Savi, M., Bocchi, L., Mena, P., Dall’Asta, M., Crozier, A., Brighenti, F., Stilli, D., Del Rio, D., In vivo administration of urolithin A and B prevents the occurrence of cardiac dysfunction in streptozotocin-induced diabetic rats. Cardiovascular diabetology, 2017. 16(1): p. 80. DOI: 10.1186/s12933-017-0561-3.
24. Tang, L., Mo, Y., Li, Y., Zhong, Y., He, S., Zhang, Y., Tang, Y., Fu, S., Wang, X., Chen, A., Urolithin A alleviates myocardial ischemia/reperfusion injury via PI3K/Akt pathway. Biochemical and Biophysical Research Communications, 2017. 486(3): p. 774-780. DOI: https://doi.org/10.1016/j.bbrc.2017.03.119.
25. Al-Jarallah, A., Igdoura, F., Zhang, Y., Tenedero, C.B., White, E.J., MacDonald, M.E., Igdoura, S.A., Trigatti, B.L., The effect of pomegranate extract on coronary artery atherosclerosis in SR-BI/APOE double knockout mice. Atherosclerosis, 2013. 228(1): p. 80-89. DOI: 10.1016/j.atherosclerosis.2013.02.025.
26. Kaplan, M., Hayek, T., Raz, A., Coleman, R., Dornfeld, L., Vaya, J., Aviram, M., Pomegranate juice supplementation to atherosclerotic mice reduces macrophage lipid peroxidation, cellular cholesterol accumulation and development of atherosclerosis. J Nutr, 2001. 131(8): p. 2082-2089. DOI: 10.1093/jn/131.8.2082.
27. Aviram, M., Dornfeld, L., Rosenblat, M., Volkova, N., Kaplan, M., Coleman, R., Hayek, T., Presser, D., Fuhrman, B., Pomegranate juice consumption reduces oxidative stress, atherogenic modifications to LDL, and platelet aggregation: studies in humans and in atherosclerotic apolipoprotein E-deficient mice. The American journal of clinical nutrition, 2000. 71(5): p. 1062-1076. DOI: 10.1093/ajcn/71.5.1062.
28. Spigoni, V., Mena, P., Cito, M., Fantuzzi, F., Bonadonna, R.C., Brighenti, F., Dei Cas, A., Del Rio, D., Effects on Nitric Oxide Production of Urolithins, Gut-Derived Ellagitannin Metabolites, in Human Aortic Endothelial Cells. Molecules, 2016. 21(8). DOI: 10.3390/molecules21081009.
29. Han, Q.A., Yan, C., Wang, L., Li, G., Xu, Y., Xia, X., Urolithin A attenuates ox-LDL-induced endothelial dysfunction partly by modulating microRNA-27 and ERK/PPAR-γ pathway. Mol Nutr Food Res, 2016. 60(9): p. 1933-1943. DOI: 10.1002/mnfr.201500827.
30. Singh, R., Chandrashekharappa, S., Bodduluri, S.R., Baby, B.V., Hegde, B., Kotla, N.G., Hiwale, A.A., Saiyed, T., Patel, P., Vijay-Kumar, M., Langille, M.G.I., Douglas, G.M., Cheng, X., Rouchka, E.C., Waigel, S.J., Dryden, G.W., Alatassi, H., Zhang, H.-G., Haribabu, B., Vemula, P.K., Jala, V.R., Enhancement of the gut barrier integrity by a microbial metabolite through the Nrf2 pathway. Nature Communications, 2019. 10(1): p. 89. DOI: 10.1038/s41467-018-07859-7.
31. Andreux, P.A., Blanco-Bose, W., Ryu, D., Burdet, F., Ibberson, M., Aebischer, P., Auwerx, J., Singh, A., Rinsch, C., The mitophagy activator urolithin A is safe and induces a molecular signature of improved mitochondrial and cellular health in humans. Nature Metabolism, 2019. 1(6): p. 595-603. DOI: 10.1038/s42255-019-0073-4.
32. Sahebkar, A., Ferri, C., Giorgini, P., Bo, S., Nachtigal, P., Grassi, D., Effects of pomegranate juice on blood pressure: A systematic review and meta-analysis of randomized controlled trials. Pharmacological Research, 2017. 115: p. 149-161. DOI: https://doi.org/10.1016/j.phrs.2016.11.018.
33. Sahebkar, A., Simental-Mendía, L.E., Giorgini, P., Ferri, C., Grassi, D., Lipid profile changes after pomegranate consumption: A systematic review and meta-analysis of randomized controlled trials. Phytomedicine, 2016. 23(11): p. 1103-1112. DOI: https://doi.org/10.1016/j.phymed.2015.12.014.
34. Sahebkar, A., Gurban, C., Serban, A., Andrica, F., Serban, M.-C., Effects of supplementation with pomegranate juice on plasma C-reactive protein concentrations: A systematic review and meta-analysis of randomized controlled trials. Phytomedicine, 2016. 23(11): p. 1095-1102. DOI: https://doi.org/10.1016/j.phymed.2015.12.008.
35. Huang, H., Liao, D., Chen, G., Chen, H., Zhu, Y., Lack of efficacy of pomegranate supplementation for glucose management, insulin levels and sensitivity: evidence from a systematic review and meta-analysis. Nutrition journal, 2017. 16(1): p. 67. DOI: 10.1186/s12937-017-0290-1.
36. Ross, M.M., Cherkerzian, S., Mikulis, N.D., Turner, D., Robinson, J., Inder, T.E., Matthews, L.G., A randomized controlled trial investigating the impact of maternal dietary supplementation with pomegranate juice on brain injury in infants with IUGR. Scientific reports, 2021. 11(1): p. 3569-3569. DOI: 10.1038/s41598-021-82144-0.
37. Pantuck, A.J., Pettaway, C.A., Dreicer, R., Corman, J., Katz, A., Ho, A., Aronson, W., Clark, W., Simmons, G., Heber, D., A randomized, double-blind, placebo-controlled study of the effects of pomegranate extract on rising PSA levels in men following primary therapy for prostate cancer. Prostate cancer and prostatic diseases, 2015. 18(3): p. 242-248. DOI: 10.1038/pcan.2015.32.
38. Vlachojannis, C., Zimmermann, B.F., Chrubasik-Hausmann, S., Efficacy and safety of pomegranate medicinal products for cancer. Evidence-based complementary and alternative medicine : eCAM, 2015. 2015: p. 258598. DOI: 10.1155/2015/258598.