Малоподвижный образ жизни усиливает риск развития хронических заболеваний, включая ожирение, диабет 2 типа и сердечно-сосудистые патологии. Широко известно, что физические упражнения вызывают ряд адаптационных процессов, которые оказывают благотворное профилактическое и лечебное влияние при хронических метаболических заболеваниях. К сожалению, соблюдать режим тренировок не всегда возможно. Развитие науки о спорте и молекулярных методов расширило понимание механизмов, запускаемых упражнениями, и привело к разработке химических веществ, которые могут имитировать положительные эффекты физических нагрузок, не требуя реальной мышечной активности. В обзоре основное внимание уделяется концепции «таблеток – заменителей упражнений» и тому, как они имитируют эффекты, вызываемые тренировками, включая окислительную трансформацию волокон, повышенное окисление жиров, ангиогенез и улучшение выносливости.
Препятствия для физических упражнений
Развитие технологий и связанные с этим изменения образа жизни привели к снижению уровня физической нагрузки и увеличению времени, проводимого сидя. Чрезмерное потребление калорий и ограниченная двигательная активность способствуют современному взрыву хронических заболеваний, таких как ожирение, диабет 2 типа, мышечная атрофия и сердечно-сосудистые патологии. Напротив, регулярные физические упражнения поддерживают гомеостаз глюкозы и вызывают физиологическую адаптацию, которые эффективно предотвращают и часто обращают вспять эти заболевания.
К сожалению, физические упражнения недостаточны повсеместно. Например, 64% пациентов изначально придерживались режима краткосрочных упражнений, но только 23% из них продолжали тренировки в течение длительного времени [1]. Более того, приверженность пациентов к упражнениям упала с 84% в начальный период контролируемых тренировок до 62% через год, а затем – до 40% через три года [2]. Несмотря на то, что 80% пациентов осознавали важность занятий, только 39% соблюдали предписанный режим [3]. Множество факторов, включая плохое физическое состояние, слабость, болезни, нехватку времени и плохую мотивацию, мешают упражнениям. Возникает вопрос: существует ли иной подход, который одновременно приносит пользу для здоровья, сопоставимую с физическими упражнениями, и, при этом, преодолевает проблему несоблюдения режима тренировок? Ущерб, вызываемый болезнями, вызванными гиподинамией, и польза физических нагрузок для здоровья побудили многих ученых искать альтернативные решения.
Фармакологическая имитация упражнения
Регулярные физические упражнения активируют ряд молекулярных путей во всей системе органов и снижают риск развития множества хронических заболеваний. Полной замены тренировок не существует, однако в последние годы интенсивно разрабатываются препараты – кандидаты в «таблетки для замены упражнений», способные стать привлекательной альтернативой для людей, которые не могут регулярно заниматься физическими упражнениями из-за ожирения, ампутации, травмы позвоночника, нарушений обмена веществ, а также заболеваний опорно-двигательного аппарата или сердечно-сосудистой системы. Сигнальные молекулы, активируемые физическими упражнениями, логично считаются мощными фармакологическими мишенями для таких веществ.
«Таблетки – заменители упражнений» – это активные соединения, которые имитируют биохимические и функциональные эффекты регулярных тренировок: трансформацию волокон, митохондриальный биогенез, улучшенное окисление жирных кислот, ангиогенез (образования кровеносных сосудов) и увеличение выносливости. Концепция «упражнений в таблетках» впервые была введена в 2004 году [4]. Далее мы рассмотрим доказательства эффективности и предполагаемые механизмы действия потенциальных «таблеток – заменителей упражнений»: AICAR, GW501516, GSK4716, SR9009, MOTS-c, иризин, эпикатехин и ресвератрол.
AICAR
AICAR (акадезин, N1-(β-D-рибофуранозил)-5-аминоимидазол-4-карбоксамид, ZMP; СAS 2627-69-2)
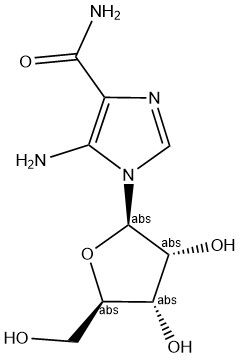
AICARявляется промежуточным метаболитом в пути de novo синтеза важного в обмене веществ инозинмонофосфата [5]. Впервые AICAR исследовали в 1992 году как метод защиты от ишемического повреждения сердца во время операции[6]. Позже AICAR изучали в лабораториях PeriCor Therapeutics как агент, регулирующий аденозин, и компании Schering-Plough. Данные показывают, что введение мышам AICAR в течение более четырех недель усиливало экспрессию генов нескольких белков, участвующих в окислительном метаболизме, а также увеличивало выносливость при беге на 44% [7]. Вероятно, что AICAR может стимулировать адаптацию к упражнениям и повысить выносливость даже без физических нагрузок. Применение AICAR в течение 14 дней значительно снизила долю гликолитических быстро сокращающихся миофибрилл (тип IIB) и одновременно вызвала еще большее увеличение окислительных и медленных мышечных волокон типа IIX в мышцах длинного разгибателя пальцев [8], что указывает на способномть AICAR индуцировать преобразование волокон в скелетных мышцах. Таким образом, AICAR может быть многообещающим кандидатом в «таблетки для упражнений».
No post found!
AICAR фармакологически активирует AMP-активированную протеинкиназу (AMPK). Важно отметить, что AMPK играет центральную роль в энергетическом метаболизме клеток и часто упоминается как «главный переключатель метаболизма». AMPK поддерживает энергетический баланс, способствуя клеточному поглощению глюкозы, β-окислению жирных кислот и биогенезу транспортера глюкозы 4 (GLUT4), одновременно ингибируя пути биосинтеза, потребляющие АТФ, обнаруживая и реагируя на колебания соотношения AMФ:АТФ, которые происходят в состоянии покоя и во время упражнений [9], а также участвует в индукции митохондриального биогенеза [10].
No post found!
AICAR увеличивает уровни белка коактиватора-1 (PGC-1α). PGC-1α представляет собой коактиватор транскрипции, который индуцирует митохондриальный биогенез и трансформацию волоконного типа в скелетных мышцах [11]. AMPK может напрямую взаимодействовать с PGC-1α. Несколько AMPK-индуцированных путей экспрессии митохондриальных генов происходят через активацию PGC-1α.
Таким образом, введение AICAR активирует AMPK, и AMPK затем взаимодействует, прямо или косвенно, с PGC-1α, вызывая улучшенный окислительный метаболизм, митохондриальный биогенез и трансформацию волокон в скелетных мышцах. Так, AICAR способен имитировать широкий спектр адаптации скелетных мышц, подобной таковому при физической нагрузке.
Один из миметиков упражнений – «соединение 14», разработанное в Саутгемптонском университете в Великобритании [12].
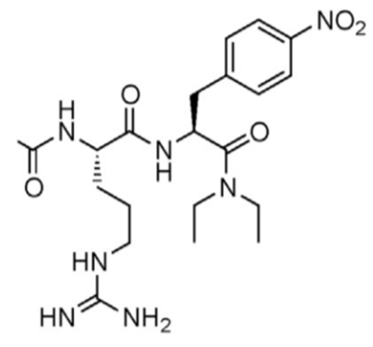
«Соединение 14» является ингибитором гомодимеризации трансформилазы AICAR и действует иначе, чем AICAR, – этот препарат ингибирует ATIC и увеличивает эндогенные уровни AICAR, приводя таким образом к активации AMPK и его последующих сигнальных путей, включая усиление окисления жирных кислот и поглощения глюкозы. Авторы [12] сообщили, что применение «соединения 14» у тучных мышей в течение семи дней снизило уровень глюкозы в крови до почти нормального уровня и улучшило толерантность к глюкозе примерно на 30%, в то же время вызвав значительную потерю массы тела у животных, получавших диету с высоким содержанием жиров. В настоящее время неясно, увеличивало ли лечение «соединением 14» способность к физической нагрузке или уровни выносливости у обработанных животных.
Важно отметить, что метформин, широко используемый при лечении диабета 2 типа, также является агентом, активирующим AMPK, снижает уровень глюкозы в крови и повышает чувствительность к инсулину [13]. Интересно, что лечение метформином в течение 7–9 дней здоровых людей немного снизило ключевые результаты, связанные с максимальной переносимостью физических нагрузок. Влияние метформина на способность к физическим нагрузкам осложняется данными о том, что препарат полностью подавляет эффект физических упражнений у пациентов с преддиабетом [14], а другие данные возражают, что он незначительно снижает положительный эффект от упражнений на гликемический контроль. Одно из возможных объяснений заключается в том, что метформин активирует AMPK в гепатоцитах и, следовательно, снижает активность ацетил-СоА-карбоксилазы (АСС), что вызывает окисление жирных кислот и подавляет экспрессию липогенных ферментов. Метформин также ингибирует комплекс 1 митохондриальной дыхательной цепи, но это, к сожалению, снижает митохондриальный резерв, созданный тренировкой, и физическую работоспособность [15]. Таким образом, метформин нельзя рассматривать в качестве кандидата в «таблетки – заменители упражнений».
GW501516
GW501516 ({2-метил-4-{{4-метил-2-[4-(трифторметил)фенил]-5-тиазолил}метилтио}фенокси}уксусная кислота, Cardarine, GSK-516, GW1516, Endurobol; CAS 317318-70-0)
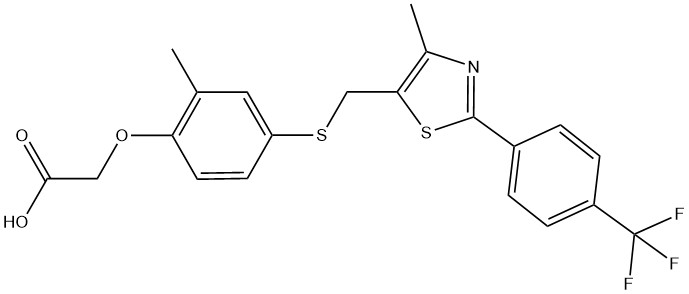
GW501516 является первоначально разработанным GlaxoSmithKline (GSK) в 1992 году агонистом рецептора PPARδ, который активируется при физических нагрузках. GW501516 предназначался для улучшения переработки жирных кислот скелетными мышцами по сравнению с углеводами, что сделало его потенциальным средством лечения ожирения, диабета 2 типа, дислипидемии и метаболического синдрома. GW501516 активирует PPARδ, тем самым вызывая физиологические адаптации, такие как трансформация типов волокон, аналогично ответу на физические упражнения. Например, в работе [7] сообщили, что GW501516 в сочетании с упражнениями синергетически увеличивал окислительные медленные волокна (тип I) и митохондриальный биогенез, что приводило к повышению выносливости. Однако применение только GW501516 не изменило состав волокон, что указывает на недостаточность фармакологической активации PPARδ самой по себе для повышения переносимости физической нагрузки.
PPARδ является членом семейства ядерных рецепторов и играет решающую роль в регуляции транскрипции метаболизма скелетных мышц [16, 17]. Тренировки с физической нагрузкой вызывают его экспрессию в волокнах скелетных мышц I типа и запускают их трансформацию. Сверхэкспрессия PPARδ приводит к митохондриальному биогенезу и высокому уровню волокон окислительного типа I [17]. Примечательно, что GW501516 и AICAR синергетически влияют на биогенез митохондрий и трансформацию типов волокон и значительно повышают выносливость при физической нагрузке больше, чем каждое соединение по отдельности [7]. Необходимы дополнительные исследования, чтобы лучше понять функциональные последствия GW501516 и поднять его профиль в качестве возможного кандидата в качестве таблетки для упражнений.
GSK4716
GSK4716 (2-[[4-(1-метилэтил)фенил]метилен]гидразид 4-гидроксибензойной кислоты; CAS 101574-65-6)
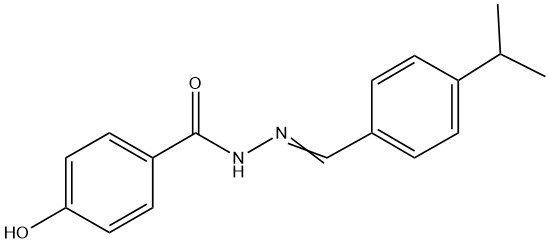
GSK4716 представляет собой синтетический низкомолекулярный агонист эстроген-связанных рецепторов (ERR) и с высокой селективностью взаимодействует с подтипом ERRγ [18]. ERR представляет собой комплекс, состоящий из трех изоформ: ERRα, ERRβ и ERRγ. Подтип ERRγ часто описывается как ключевой регулятор фенотипа окислительных мышечных волокон и специфически экспрессируется в скелетных мышцах с медленным сокращением, играя важную роль в повышении переносимости физической нагрузки, активации митохондриального биогенеза и контроле ангиогенеза и миофибриллярной трансформации. Недавние данные показывают, что обработка мышечных канальцев GSK4716 индуцировала повышенную регуляцию ERRγ и его коактиваторов [19]. Структурное ремоделирование и функциональные улучшения, вызванные ERRγ, связаны с активацией AMPK в мышцах [20].
Таким образом, GSK4716 активирует ERRγ для индукции миофибриллярной трансформации, ангиогенеза, митохондриального биогенеза и улучшения физической работоспособности, а также может дать часть преимуществ, получаемых от упражнений. GSK4716 может считаться потенциальной «таблеткой для упражнений».
SR9009
SR9009 ((этил-3-({(4-хлорбензил)[(5-нитротиофен-2-ил)метил]амино}метил)пирролидин-1-карбоксилат), Reverol, Stenabolic, Plavix,; CAS 1379686-30-2)
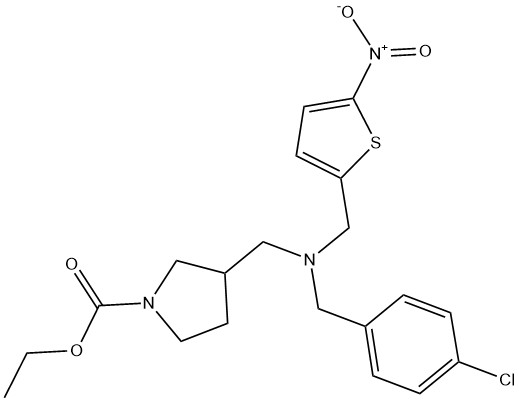
SR9009 – это синтетический агонист REV-ERBα, разработанный в 2012 году в Исследовательском институте Скриппса [21]. REV-ERBα является членом семейства ядерных рецепторов REV-ERB. Повышение уровня экспрессии REV-ERBα увеличивает содержание и количество митохондрий и снижает аутофагию, таким образом улучшая переносимость физической нагрузки. Исследованиеin vivo показало, что однократная инъекция SR9009 индуцировала экспрессию генов, связанных с катаболизмом жирных кислот, и увеличивала митохондриальную активность; введение в течение 12 дней увеличивало потребление энергии без изменения RER, и через 30 дней значительно продлило время бега мышей. Кроме того, обработка клеток миокарда мышейin vitro с помощью SR9009 увеличивала количество митохондрий. В отличие от других ядерных рецепторов, REV-ERBα запускает митохондриальный биогенез в скелетных мышцах посредством модуляции киназы печени B1 (Lkb1), не вызывая переключения типов мышечных волокон [22]. Кроме того, REV-ERBα также является компонентом циркадных часов и играет важную роль в регулировании ритмических изменений активности и метаболизма. Вероятно, что SR9009 изменяет циркадную регуляцию скелетных мышц, что приводит к увеличению расхода энергии [21].
Таким образом, фармакологический агонист REV-ERBα усиливает биогенез митохондрий и улучшает окислительную функцию. SR9009 может быть многообещающей «таблеткой – заменителем упражнений», которая имитирует положительное влияние физических нагрузок на энергетический обмен.
MOTS-c
MOTS-c (H-Met-Arg-Trp-GlnGlu-Met-Gly-Tyr-Ile-Phe-TyrPro-Arg-Lys-Leu-Arg-OH; CAS 1627580-64-6). MOTS-c (митохондриальная открытая рамка считывания 12S рРНК-c), пептидный гормон, кодируемый в ДНК митохондрий [23]. Препарат способствует накоплению эндогенного AICAR, активатора AMPK. MOTS-c, как митокин, т. е., пептид, выделяемый при митохондриальном стрессе, оказывает системное действие, но в основном воздействует на скелетные мышцы [24]. Введение MOTS-c устраняет инсулин-резистентность, улучшает метаболический гомеостаз мышей, получавших пищу с большим содержанием жиров [25]. В принципе, данный митохондриальный сигнальный пептид действует на фолатный цикл в мышцах и последовательно блокирует связанный путь биосинтеза пуринов de novo, что приводит к накоплению AICAR, активации AMPK и поддержанию метаболического гомеостаза. Кроме того, MOTS-c также регулирует клеточный и системный метаболизм глюкозы и восстанавливает чувствительность к инсулину. MOTS-c – кандидат в «таблетки – заменители упражнений». Требуются дополнительные исследования, чтобы лучше понять его механизм в краткосрочной и долгосрочной перспективе.
Иризин
Иризин (фрагмент белка FNDC5, irisin) – это миокин, белок, образующийся в ответ на мышечное сокращение, впервые идентифицированный в 2012 году [26]. Иризин секретируется скелетными мышцами в ответ на физическую нагрузку и воздействует на белую жировую ткань [27]. Физические упражнения индуцируют PGC-1α в мышцах, а PGC-1α стимулируют экспрессию генов белка 5, содержащего домен фибронектина III типа (FNDC5). Ген FNDC5 кодирует белок FNDC5, который подвергается посттрансляционной обработке с образованием иризина, который затем секретируется в кровоток. Иризин стимулирует потемнение белого жира и увеличивает термогенез и расход энергии. Например, инъекции иризина в течение 10 дней вызывают потерю веса и поддерживают гомеостаз глюкозы у тучных мышей [26]. Таким образом, иризин имитирует некоторые важные положительные эффекты физических упражнений.
Несмотря на ряд исследований, демонстрирующих, что иризин обладает эффектами, подобными физическим упражнениям, также было показано, что экспрессия мРНК FNDC5 не изменилась в биоптатах мышц человека из исследований выносливости и силовых тренировок, что поставило под сомнение возможность положительного воздействия иризина [28]. В некоторых исследованиях делаются противоречивые утверждения о взаимосвязи между уровнями циркулирующего иризина и физическими упражнениями. Анализ методом вестерн-блот с четырьмя различными антителами, чувствительная система обнаружения и изучения циркулирующего иризина у людей и нескольких видов животных, продемонстрировал неизменные уровни иризина в сыворотке до и после тренировки [29]. Количественная масс-спектрометрия (независимый от антител метод) для определения уровней пептида иризина в плазме человека показал, что концентрации циркулирующего иризина (3,6 нг/мл у людей, ведущих малоподвижный образ жизни) были значительно увеличены (до 4,3 нг/мл) при аэробных интервальных тренировках [30]. Необходимы дополнительные исследования для более подробного изучения этого вопроса с акцентом на методы и уровни выявления при острых и хронических упражнениях различной степени интенсивности.
(-)-Эпикатехин
(-)-Эпикатехин ((2R,3S)-2-(3,4-дигидроксифенил)-3,4-дигидро-2H-хромен-3,5,7-триол; CAS 18829-70-4)
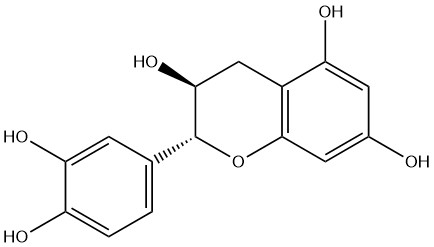
Натуральный флавоноид (-)-эпикатехин присутствует в таких растениях, как какао, чай и виноград, и усиливает ангиогенез и функцию митохондрий как в покое, так и после упражнений на выносливость. В исследовании сообщалось, что (-)-эпикатехин отдельно или вместе с физической нагрузкой индуцировал структурную и метаболическую адаптацию скелетных и сердечных мышц и улучшал выносливость [31]. Другие эксперименты показали, что применение (-)-эпикатехина значительно усиливало митохондриальные сигналы и кумулятивно улучшало физическую работоспособность после восьми недель тренировок [32]. Кроме того, (-)-эпикатехин может также улучшать формирование капилляров миокарда в ответ на физическую нагрузку [33].
Благоприятные эффекты (-)-эпикатехина могут быть связаны с активацией сигнальных путей фактора роста эндотелия сосудов (VEGF), эндотелиальной синтазы оксида азота (eNOS) и оксида азота (NO). Некоторые исследования на животных показывают, что (-)-эпикатехин увеличивает продукцию NO в эндотелиальных клетках и ослабляет повреждение миокарда. Несколько работ подтверждают, что путь NO может играть роль в митохондриальном биогенезе и ангиогенезе в скелетных мышцах.
Таким образом, (-)-эпикатехин имитирует многие полезные свойства упражнений, такие как улучшение митохондриальной функции и усиление образования капилляров в скелетных и сердечных мышцах, что создает многообещающую основу для его потенциального применения в качестве «таблетки – заменителе упражнений».
Ресвератрол
Ресвератрол (транс-3,5,4′-тригидроксистильбен; CAS 501-36-0)
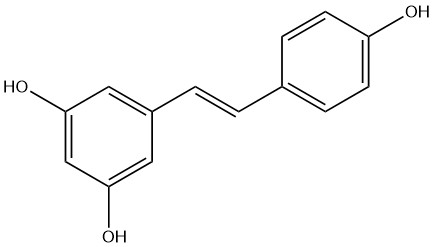
Ресвератрол – природный антиоксидантный полифенол, присутствующий во многих продуктах питания, включая красное вино, виноград и чернику. Ресвератрол, подобно тренировкам, усиливает биогенез митохондрий, стимулирует ангиогенез, улучшает работоспособность и повышает чувствительность к инсулину. В экспериментах показано, что у мышей, получавших ресвератрол, улучшилась митохондриальная функция и выносливость [34], а введение ресвератрола в течение 12 недель повышало экспрессию AMPK и толерантность к инсулину в модели диабета 2 типа с ожирением [35]. Более того, исследования на людях демонстрируют аналогичные адаптационные процессы, запускаемые ресвератролом за счет улучшения митохондриальной эффективности [36]. Как и при тренировке с физической нагрузкой, ресвератрол активирует чувствительный к энергии фермент AMPK [37].
Однако обратные результаты были описаны в работе [37], где авторы сообщили, что ресвератрол не влияет на биогенез митохондрий, несмотря на активацию AMPK в клетках скелетных мышц. Противоречивые результаты различных исследований могут быть связаны с различиями в дозировках используемого ресвератрола, что подтверждается несколькими исследованиями, показывающими, что дозировка играет решающую роль в благоприятных эффектах ресвератрола, и что обычные количества ресвератрола слишком малы, чтобы вызвать изменения митохондриальных свойств [38]. Таким образом, необходимы дальнейшие исследования, чтобы понять оптимальную дозировку ресвератрола, необходимую для того, чтобы вызвать у людей эффекты, аналогичные физическим упражнениям.
Заключение
Концепция «таблеток – заменителей упражнений» имеет большой потенциал для использования у пациентов, плохо соблюдающих режим тренировок, или когда регулярные упражнения невозможны.
Кандидатные «таблетки – заменители упражнений» можно разделить на три категории: фармакологические агонисты (AICAR, GW501516, GSK4716 и SR9009), гормоны (MOST-c и иризин) и фитохимические вещества [ресвератрол и (-)-эпикатехин]. За исключением двух последний растительных соединений, которые не используются для имитации физических упражнений, другие препараты все еще находятся на экспериментальной стадии. Ни один из них полностью не воспроизводит полную палитру положительных эффектов упражнений, но каждое вещество может активировать как отдельные, так и перекрывающиеся целевые регуляторы транскрипции, которые частично имитируют в некоторых органах положительные эффекты, вызываемые физическими упражнениями, и повышают выносливость. Дальнейшая разработка таких препаратов, особенно действующих в сочетании, может оказаться более эффективной, чем отдельные соединения.
Многие аспекты действия известных «таблеток – заменителей упражнений» до сих пор полностью не изучены, включая побочные эффекты, оптимальную дозировку и неправильное использование. Некоторые исследования показывают, что активация AMPK снижает синтез белка и увеличивает аутофагию, что приводит к хроническому катаболическому состоянию. Между тем, увеличение PGC-1α в скелетных мышцах мышей вызывает тяжелую атрофию мышц с возрастом [39]. Кроме того, в 2013 году был зарегистрирован первый случай применения GW501516 в качестве допинга на велосоревнованиях [40], что повысило потребность в дополнительных исследованиях фармакокинетики и фармакодинамических эффектов «таблеток – заменителей упражнений» у людей.
Препараты, имитирующие упражнения, все еще находятся на начальном этапе разработки, и им предстоит долгий путь до получения клинического применения. Однако растущее понимание механизмов возникновения положительных эффектов вселяет большую уверенность в создании «таблеток – заменителей упражнений» с минимальными побочными реакциями и гораздо большей эффективностью.
Обзор основан на материалах работы [41].
Лигандрол (Ligandrol, LGD-4033, SARM,САРМ)
Радарин (Radarine, RAD-140, SARM, САРМ)
Лоркасерин: снижение аппетита и лечение ожирения
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
Реверол, Рекардин и другие лиганды рецептора REV-ERB. При дистрофии и для регенерации мышц
Ибутаморен (Ibutamoren, MK-677)
1. Sluijs, E., Kuijper, E.J.N.T.v.F., Problems patients encounter in educating patients. 1990. 100: p. 128-132.
2. Conraads, V.M., Deaton, C., Piotrowicz, E., Santaularia, N., Tierney, S., Piepoli, M.F., Pieske, B., Schmid, J.-P., Dickstein, K., Ponikowski, P.P., Jaarsma, T., Adherence of heart failure patients to exercise: barriers and possible solutions. European Journal of Heart Failure, 2012. 14(5): p. 451-458. DOI: https://doi.org/10.1093/eurjhf/hfs048.
3. van der Wal, M.H.L., Jaarsma, T., Moser, D.K., Veeger, N.J.G.M., van Gilst, W.H., van Veldhuisen, D.J., Compliance in heart failure patients: the importance of knowledge and beliefs. European Heart Journal, 2006. 27(4): p. 434-440. DOI: 10.1093/eurheartj/ehi603.
4. Himms-Hagen, J., Exercise in a Pill: Feasibility of Energy Expenditure Targets. Current Drug Targets — CNS & Neurological Disorders, 2004. 3(5): p. 389-409. DOI: http://dx.doi.org/10.2174/1568007043337076.
5. Sabina, R.L., Holmes, E.W., Becker, M.A., The enzymatic synthesis of 5-amino-4-imidazolecarboxamide riboside triphosphate (ZTP). Science, 1984. 223(4641): p. 1193-1195. DOI: 10.1126/science.6199843.
6. Galiñanes, M., Bullough, D., Mullane, K.M., Hearse, D.J., Sustained protection by acadesine against ischemia- and reperfusion-induced injury. Studies in the transplanted rat heart. Circulation, 1992. 86(2): p. 589-597. DOI: 10.1161/01.cir.86.2.589.
7. Narkar, V.A., Downes, M., Yu, R.T., Embler, E., Wang, Y.-X., Banayo, E., Mihaylova, M.M., Nelson, M.C., Zou, Y., Juguilon, H., Kang, H., Shaw, R.J., Evans, R.M., AMPK and PPARδ Agonists Are Exercise Mimetics. Cell, 2008. 134(3): p. 405-415. DOI: https://doi.org/10.1016/j.cell.2008.06.051.
8. Suwa, M., Nakano, H., Kumagai, S., Effects of chronic AICAR treatment on fiber composition, enzyme activity, UCP3, and PGC-1 in rat muscles. Journal of Applied Physiology, 2003. 95(3): p. 960-968. DOI: 10.1152/japplphysiol.00349.2003.
9. Hardie, D.G., Ross, F.A., Hawley, S.A., AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nature Reviews Molecular Cell Biology, 2012. 13(4): p. 251-262. DOI: 10.1038/nrm3311.
10. Xu, X.J., Valentine, R.J., Ruderman, N.B., AMP-activated Protein Kinase (AMPK): Does This Master Regulator of Cellular Energy State Distinguish Insulin Sensitive from Insulin Resistant Obesity? Current Obesity Reports, 2014. 3(2): p. 248-255. DOI: 10.1007/s13679-014-0095-x.
11. Li, J., Kinoshita, T., Pandey, S., Ng, C.K.Y., Gygi, S.P., Shimazaki, K.-i., Assmann, S.M., Modulation of an RNA-binding protein by abscisic-acid-activated protein kinase. Nature, 2002. 418(6899): p. 793-797. DOI: 10.1038/nature00936.
12. Asby, Daniel J., Cuda, F., Beyaert, M., Houghton, Franchesca D., Cagampang, Felino R., Tavassoli, A., AMPK Activation via Modulation of De Novo Purine Biosynthesis with an Inhibitor of ATIC Homodimerization. Chemistry & Biology, 2015. 22(7): p. 838-848. DOI: 10.1016/j.chembiol.2015.06.008.
13. Zhou, G., Myers, R., Li, Y., Chen, Y., Shen, X., Fenyk-Melody, J., Wu, M., Ventre, J., Doebber, T., Fujii, N., Musi, N., Hirshman, M.F., Goodyear, L.J., Moller, D.E., Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest, 2001. 108(8): p. 1167-1174. DOI: 10.1172/JCI13505.
14. Malin, S.K., Gerber, R., Chipkin, S.R., Braun, B., Independent and Combined Effects of Exercise Training and Metformin on Insulin Sensitivity in Individuals With Prediabetes. Diabetes Care, 2012. 35(1): p. 131. DOI: 10.2337/dc11-0925.
15. Cadeddu, C., Nocco, S., Deidda, M., Cadeddu, F., Bina, A., Demuru, P., Cossu, E., Baroni, M., Mercuro, G., Cardiopulmonary and endothelial effects of metformin treatment in an insulin resistant population. International journal of cardiology, 2012. 158(2): p. 302-304. DOI: 10.1016/j.ijcard.2012.04.113.
16. Luquet, S., Lopez-Soriano, J., Holst, D., Fredenrich, A., Melki, J., Rassoulzadegan, M., Grimaldi, P.A., Peroxisome proliferator-activated receptor delta controls muscle development and oxidative capability. FASEB journal: official publication of the Federation of American Societies for Experimental Biology, 2003. 17(15): p. 2299-2301. DOI: 10.1096/fj.03-0269fje.
17. Wang, Y.X., Zhang, C.L., Yu, R.T., Cho, H.K., Nelson, M.C., Bayuga-Ocampo, C.R., Ham, J., Kang, H., Evans, R.M., Regulation of muscle fiber type and running endurance by PPARdelta. PLoS biology, 2004. 2(10): p. e294. DOI: 10.1371/journal.pbio.0020294.
18. Zuercher, W.J., Gaillard, S., Orband-Miller, L.A., Chao, E.Y., Shearer, B.G., Jones, D.G., Miller, A.B., Collins, J.L., McDonnell, D.P., Willson, T.M., Identification and structure-activity relationship of phenolic acyl hydrazones as selective agonists for the estrogen-related orphan nuclear receptors ERRbeta and ERRgamma. J Med Chem, 2005. 48(9): p. 3107-3109. DOI: 10.1021/jm050161j.
19. Rangwala, S.M., Wang, X., Calvo, J.A., Lindsley, L., Zhang, Y., Deyneko, G., Beaulieu, V., Gao, J., Turner, G., Markovits, J., Estrogen-related receptor gamma is a key regulator of muscle mitochondrial activity and oxidative capacity. The Journal of biological chemistry, 2010. 285(29): p. 22619-22629. DOI: 10.1074/jbc.M110.125401.
20. Narkar, V.A., Fan, W., Downes, M., Yu, R.T., Jonker, J.W., Alaynick, W.A., Banayo, E., Karunasiri, M.S., Lorca, S., Evans, R.M., Exercise and PGC-1α-independent synchronization of type I muscle metabolism and vasculature by ERRγ. Cell Metab, 2011. 13(3): p. 283-293. DOI: 10.1016/j.cmet.2011.01.019.
21. Solt, L.A., Wang, Y., Banerjee, S., Hughes, T., Kojetin, D.J., Lundasen, T., Shin, Y., Liu, J., Cameron, M.D., Noel, R., Yoo, S.-H., Takahashi, J.S., Butler, A.A., Kamenecka, T.M., Burris, T.P., Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists. Nature, 2012. 485(7396): p. 62-68. DOI: 10.1038/nature11030.
22. Woldt, E., Sebti, Y., Solt, L.A., Duhem, C., Lancel, S., Eeckhoute, J., Hesselink, M.K.C., Paquet, C., Delhaye, S., Shin, Y., Kamenecka, T.M., Schaart, G., Lefebvre, P., Nevière, R., Burris, T.P., Schrauwen, P., Staels, B., Duez, H., Rev-erb-α modulates skeletal muscle oxidative capacity by regulating mitochondrial biogenesis and autophagy. Nat Med, 2013. 19(8): p. 1039-1046. DOI: 10.1038/nm.3213.
23. Kim, S.-J., Xiao, J., Wan, J., Cohen, P., Yen, K., Mitochondrially derived peptides as novel regulators of metabolism. The Journal of Physiology, 2017. 595(21): p. 6613-6621. DOI: 10.1113/JP274472.
24. Zarse, K., Ristow, M., A mitochondrially encoded hormone ameliorates obesity and insulin resistance. Cell Metab, 2015. 21(3): p. 355-356. DOI: 10.1016/j.cmet.2015.02.013.
25. Lee, C., Zeng, J., Drew, B.G., Sallam, T., Martin-Montalvo, A., Wan, J., Kim, S.J., Mehta, H., Hevener, A.L., de Cabo, R., Cohen, P., The mitochondrial-derived peptide MOTS-c promotes metabolic homeostasis and reduces obesity and insulin resistance. Cell Metab, 2015. 21(3): p. 443-454. DOI: 10.1016/j.cmet.2015.02.009.
26. Boström, P., Wu, J., Jedrychowski, M.P., Korde, A., Ye, L., Lo, J.C., Rasbach, K.A., Boström, E.A., Choi, J.H., Long, J.Z., Kajimura, S., Zingaretti, M.C., Vind, B.F., Tu, H., Cinti, S., Højlund, K., Gygi, S.P., Spiegelman, B.M., A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature, 2012. 481(7382): p. 463-468. DOI: 10.1038/nature10777.
27. Sanchis-Gomar, F., Lippi, G., Mayero, S., Perez-Quilis, C., García-Giménez, J.L., Irisin: a new potential hormonal target for the treatment of obesity and type 2 diabetes. Journal of diabetes, 2012. 4(3): p. 196. DOI: 10.1111/j.1753-0407.2012.00194.x.
28. Raschke, S., Elsen, M., Gassenhuber, H., Sommerfeld, M., Schwahn, U., Brockmann, B., Jung, R., Wisløff, U., Tjønna, A.E., Raastad, T., Hallén, J., Norheim, F., Drevon, C.A., Romacho, T., Eckardt, K., Eckel, J., Evidence against a beneficial effect of irisin in humans. PLoS One, 2013. 8(9): p. e73680. DOI: 10.1371/journal.pone.0073680.
29. Albrecht, E., Norheim, F., Thiede, B., Holen, T., Ohashi, T., Schering, L., Lee, S., Brenmoehl, J., Thomas, S., Drevon, C.A., Erickson, H.P., Maak, S., Irisin – a myth rather than an exercise-inducible myokine. Scientific Reports, 2015. 5(1): p. 8889. DOI: 10.1038/srep08889.
30. Jedrychowski, Mark P., Wrann, Christiane D., Paulo, Joao A., Gerber, Kaitlyn K., Szpyt, J., Robinson, Matthew M., Nair, K.S., Gygi, Steven P., Spiegelman, Bruce M., Detection and Quantitation of Circulating Human Irisin by Tandem Mass Spectrometry. Cell Metabolism, 2015. 22(4): p. 734-740. DOI: 10.1016/j.cmet.2015.08.001.
31. Nogueira, L., Ramirez-Sanchez, I., Perkins, G.A., Murphy, A., Taub, P.R., Ceballos, G., Villarreal, F.J., Hogan, M.C., Malek, M.H., (-)-Epicatechin enhances fatigue resistance and oxidative capacity in mouse muscle. The Journal of physiology, 2011. 589(Pt 18): p. 4615-4631. DOI: 10.1113/jphysiol.2011.209924.
32. Lee, I., Hüttemann, M., Kruger, A., Bollig-Fischer, A., Malek, M.H., (-)-Epicatechin combined with 8 weeks of treadmill exercise is associated with increased angiogenic and mitochondrial signaling in mice. Frontiers in pharmacology, 2015. 6: p. 43. DOI: 10.3389/fphar.2015.00043.
33. Ramirez-Sanchez, I., Nogueira, L., Moreno, A., Murphy, A., Taub, P., Perkins, G., Ceballos, G.M., Hogan, M., Malek, M., Villarreal, F., Stimulatory effects of the flavanol (-)-epicatechin on cardiac angiogenesis: additive effects with exercise. Journal of cardiovascular pharmacology, 2012. 60(5): p. 429-438. DOI: 10.1097/FJC.0b013e318269ae0d.
34. Lagouge, M., Argmann, C., Gerhart-Hines, Z., Meziane, H., Lerin, C., Daussin, F., Messadeq, N., Milne, J., Lambert, P., Elliott, P., Geny, B., Laakso, M., Puigserver, P., Auwerx, J., Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. Cell, 2006. 127(6): p. 1109-1122. DOI: 10.1016/j.cell.2006.11.013.
35. Chen, S., Li, J., Zhang, Z., Li, W., Sun, Y., Zhang, Q., Feng, X., Zhu, W., Effects of resveratrol on the amelioration of insulin resistance in KKAy mice. Canadian journal of physiology and pharmacology, 2012. 90(2): p. 237-242. DOI: 10.1139/y11-123.
36. Goh, K.P., Lee, H.Y., Lau, D.P., Supaat, W., Chan, Y.H., Koh, A.F., Effects of resveratrol in patients with type 2 diabetes mellitus on skeletal muscle SIRT1 expression and energy expenditure. International journal of sport nutrition and exercise metabolism, 2014. 24(1): p. 2-13. DOI: 10.1123/ijsnem.2013-0045.
37. Higashida, K., Kim, S.H., Jung, S.R., Asaka, M., Holloszy, J.O., Han, D.H., Effects of resveratrol and SIRT1 on PGC-1α activity and mitochondrial biogenesis: a reevaluation. PLoS biology, 2013. 11(7): p. e1001603. DOI: 10.1371/journal.pbio.1001603.
38. Walle, T., Hsieh, F., DeLegge, M.H., Oatis, J.E., Jr., Walle, U.K., High absorption but very low bioavailability of oral resveratrol in humans. Drug Metab Dispos, 2004. 32(12): p. 1377-1382. DOI: 10.1124/dmd.104.000885.
39. Miura, S., Tomitsuka, E., Kamei, Y., Yamazaki, T., Kai, Y., Tamura, M., Kita, K., Nishino, I., Ezaki, O., Overexpression of peroxisome proliferator-activated receptor gamma co-activator-1alpha leads to muscle atrophy with depletion of ATP. The American journal of pathology, 2006. 169(4): p. 1129-1139. DOI: 10.2353/ajpath.2006.060034.
40. Pokrywka, A., Cholbinski, P., Kaliszewski, P., Kowalczyk, K., Konczak, D., Zembron-Lacny, A., Metabolic modulators of the exercise response: doping control analysis of an agonist of the peroxisome proliferator-activated receptor δ (GW501516) and 5-aminoimidazole-4-carboxamide ribonucleotide (AICAR). Journal of physiology and pharmacology: an official journal of the Polish Physiological Society, 2014. 65(4): p. 469-476.
41. Li, S., Laher, I., Exercise Pills: At the Starting Line. Trends in Pharmacological Sciences, 2015. 36(12): p. 906-917. DOI: 10.1016/j.tips.2015.08.014.