Radarine (RAD140) – представитель группы SARMs (селективных модуляторов андрогенных рецепторов, Selective Androgen Receptor Modulators), синтетическое анаболическое соединение, которое связывается с андрогенными рецепторами. RAD140 показал активность против атрофии мышц и нейропротекторные свойства на животных моделях. RAD140 действует как противораковый препарат и находится в начальной фазе клинических исследований против рака груди. RAD140 используется спортсменами как запрещенный допинг. В обзоре рассмотрены результаты доклинических и клинических испытаний Radarine, а также особенности применения для целей бодибилдинга.
Селективные модуляторы андрогенных рецепторов (Selective Androgen Receptor Modulators, SARMs) – группа химических соединений, разработанных в 1990-ых годах, которые выборочно действуют на андрогенный рецептор (AR). Результатом такого взаимодействия становится усиленный анаболизм, что выражается в увеличении мышечной массы и силы, повышенной производительности и ускоренном восстановлении после физических нагрузок [1]. С наиболее яркими представителями SARMs, их структурой, кратким описанием работы андрогенного рецептора и результатами клинических испытаний можно ознакомиться в нашем предыдущем обзоре. Далее будет рассмотрен препарат Radarine, который относится к экспериментальным SARMs, разрабатываемым для лечения таких заболеваний, как рак молочной железы и мышечное истощение.
Radarine, общая характеристика
Radarine (RAD140, RAD-140, Testolone, Радарин; 4-({2-гидроксипропил(1R,2S)-1-[5-(4-цианофенил)-1,3,4-оксадиазол-2-ил]}амино)-3-метил-2-хлорбензонитрил; CAS 1182367-47-0)
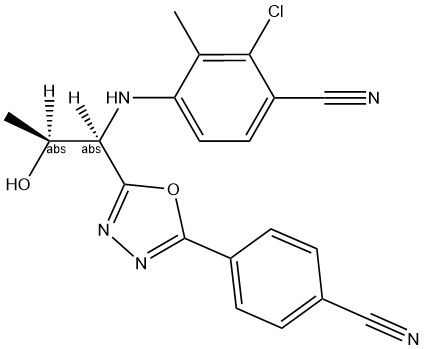
Radarine (торговое наименование – Testolone) является синтетическим нестероидным агонистом андрогенного рецептора. Препарат был разработан в 2010 году корпорацией Radius Health Inc. [2]. В процессе скрининга Radarine выявили как молекулу-кандидат для дальнейших доклинических исследований, одним из преимуществ которого можно считать хорошую биодоступность при пероральном приеме.
Стабильность RAD140 оказалась высокой, с периодом полураспада свыше двух часов, что было подтверждено путем инкубирования с микросомами грызунов, приматов и человека. Radarine на крысах продемонстрировал достаточную биодоступность 27–63%. На приматах биодоступность достигала 65–75%. Radarine продемонстрировал высокое сродство к AR (Ki=7 нМ против 29 нМ для тестостерона или 10 нМ для дигидротестостерона). Относительно иных стероидных гормональных рецепторов селективность была высокой, а ближайшим нецелевым оказался рецептор прогестерона: концентрация полумаксимального ингибирования оказалась 750 нМ против 0,2 нМ в случае прогестерона. Функциональную андроген-агонистическую активность подтвердили in vitro путем теста по дифференциации остеобластов: полумаксимальная эффективная концентрация составила 0,1 нМ (ср. для дигидротестостерона – 0,05 нМ) [2].
Доклинические исследования
Анаболические эффекты
Radarine охарактеризован в серии in vivo тестов, которые позволили определить егопероральную эффективность на доклинических моделях. Radarine вводили молодым кастрированным самцам крыс или интактным животным, чтобы оценить воздействие на эндогенные андрогенные сигнальные системы. Кастрированные в молодом возрасте крысы представляет собой очень чувствительный in vivo тест на андрогенное действие, так как животные остаются практически андроген-наивными; в результате, действие введенного экзогенного вещества ложится на практически нулевой фон. Radarine стимулировал рост веса мышц levator ani, начиная от дозировки 0,03 мг/кг, достигая уровня эффективности, эквивалентного ложнооперированному грызуну в дозе 0,3 мг/кг [2].
RAD140 не достигал уровня стимуляции увеличения семенных пузырьков или простаты, равного эффектам тестостерон пропионата при дозировке 1 мг/кг, поэтому исследователи применили совместное введение обоих препаратов. Высокая доза Radarine (10 мг/кг, перорально) фактически антагонизирует действие пропионата тестостерона эти органы, однако увеличивает эффективность по отношению мышц levator ani. Эффективная для достижения антагонизма дозировка Radarine составляет 0,3–1 мг/кг при пероральном введении при использовании 1 мг/кг подкожно тестостерон пропионата. Таким образом, на модели крыс-кастратов Radarine выступает мощным, полным агонистом андрогенов относительно мышц levator ani, в плане воздействия на семенные пузырьки, как, вероятно, и на простату, препарат выступает частичным и менее сильным антагонистом [2].
RAD140 увеличил вес levator ani молодых неоперированных самцов относительно контроля, начиная с самой низкой испытанной дозировки, составлявшей 0,1 мг/кг. Любопытно, но Radarine не демонстрировал стимуляцию простаты выше уровня неоперированных грызунов ниже самой высокой дозы, которая равнялась 30 мг/кг. При дозировке 0,3 мг/кг Radarine показал эффективность в мышцах, аналогичную пропионату тестостерона в дозе 0,5 мг/кг, но в простате для приближения к эффектам 0,5 мг/кг требовалось 30 мг/кг Radarine [2].
На молодых самцах макак-крабоедов (Macaca fascicularis) были установлены эффективные уровни дозировки для приматов. Анаболическую активность оценивали по изменению всей массы тела, являющейся у молодых представителей семейства мартышковых восприимчивым предиктором анаболических эффектов андрогенов. По результатам оценки массы тела животных при 28-дневном приеме Radarine в дозировках 0,01, 0,1 и 1 мг/кг/день, перорально, оказалось, что масса увеличивалась дозозависимым образом: действие 1 мг/кг превышало на 10% действие 0,01 мг/кг через три недели эксперимента. Контролем служило фоновое изменение веса каждого животного за недели, предшествующие эксперименту. Средний прирост массы свыше 10% был достигнут при введении 0,1 мг/кг всего за 28 дней приема препарата, причем аналогичный результат продемонстрирован на группе животных, получавших 1,0 мг/кг. Невзирая, что возрастание массы преимущественно произошло за счет увеличения безжировой ткани, статистически изменение не оказалось значимым. Клинико-химический анализ показал предсказанное понижение концентрации липидов. Несмотря на довольно резкое возрастание веса макак за столь короткий период времени, ни у одной особи со всеми испытанными дозировками не было выявлено повышения выработки печеночных трансаминаз в, двукратного относительно исходного значения. С учетом связи между пероральным применением андрогенов и показателями стресса печени, хорошим признаком было, что при дозировке, в десять раз превышающей полностью эффективную дозу, наблюдалось минимальное повышение уровня ферментов печени.
Нейропротекторные эффекты
Подобно тестостерону, Radarine при концентрации 100 нМ способен действовать на нервные клетки in vitro, и снижать их гибель, приводя к нейропротекторным эффектам на том же уровне, что и тестостерон [3]. Для подтверждения этого, гонадэктомированным (GDX) крысам вводили перорально раствор с 1 мг/кг RAD140 ежедневно в течение двух недель. Эта доза была выбрана на основании предыдущих сообщений об эффективности RAD140. Животные из контрольной группы получали аналогичный раствор, не содержащий SARM. На 13-ый день двухнедельного периода гормональной терапии крысам вводили подкожно стимулятор ЦНС – каинат (10 мг/кг), действие которого имитирует болезнь Альцгеймера, или стерильную воду. На 14-ый день крысам, получавшим Radarine, вводили 1 мг/мл RAD140, суспендированного в сафлоровом масле, путем инъекции через рот, поскольку после поражения каинатом пероральный прием затруднен. По окончании экспериментального периода животных подвергали эвтаназии.
По сравнению с обработкой неактивным раствором, каинат вызывал приблизительно 20% потерю клеток у ложнооперированных животных и до 60% – у крыс GDX. Выживаемость клеток у животных GDX после применения Radarine была сопоставима с ложнооперированными и составляла 80%. Для сравнения, обработка тестостероном сохраняла до 85% живых нейронов. RAD140 вызывал тканеспецифические андрогенные эффекты. Средний вес тканей у самцов крыс в условиях ложной операции, GDX, GDX+тестостерон и GDX+RAD140 соответствовал 1,5, 0,3, 1,4 и 0,5 г для семенных пузырьков; 0,8, 0,4, 0,75 и 0,8 г для мышц levator ani; и 0,62, 0,05, 0,7 и 0,2 г в случае простаты.
Противораковое действие
Приблизительно 70–85% раковых опухолей молочной железы экспрессируют AR — интересно, что это немного выше, чем показатели экспрессии рецептора эстрогена (ER) и рецептора прогестерона (PR) в раке молочной железы [4]. В целом, ER-положительные (ER+) опухоли, как правило, чаще экспрессируют AR, чем ER-отрицательные. В мета-анализе, включавшем 7693 женщины, сообщалось, что 74,8% ER+ и 31,8% ER-отрицательных типов рака молочной железы экспрессируют AR.
Radarine на моделях рака груди in vivo и in vitro активирует AR и подавляет гены, связанные с рецептором эстрогена 1 (ESR1) [5]. RAD140 связывал AR с высокой аффинностью и специфичностью и активировал AR в клеточных линиях ZR-75-1, HCC1428 и T47D рака молочной железы, но не рака простаты линии LNCaP. Radarine ингибировал пролиферацию клеток при концентрациях 10–100 нМ, с максимальным эффектом при 100 нМ – снижение числа живых клеток до 25% от их исходного количества.
В качестве моделей ксенотрансплантатов рака молочной железы HBCx-22, HBCx-21 и HBCx-3, полученных от пациентов (PDX), использовались фрагменты опухоли, имплантированные подкожно самкам мышей. Пероральный прием 100 мг/кг один раз в день RAD140 существенно подавлял рост ксенотрансплантатов, полученных от пациентов с раком молочной железы AR/ER+ (PDXs). Пероральный прием RAD140 вызвал значительное подавление роста опухоли (TGI) на 76%, 59% и 58% по сравнению с контрольными группами в ксенотрансплантатах HBCx-22, HBCx-3 и HBCx-21, соответственно. Объем опухоли через 50 дней составлял ~75% – от объема у получавших 1 мг/нед фульвестрант.
Активация AR и подавление ER-пути, включая ген ESR1, наблюдались при обработке с помощью RAD140. Совместное назначение RAD140 и палбоциклиба показало более высокую эффективность в моделях PDX AR/ER+ [6]. Механистическое исследование показало, что ингибирование опухолевого роста с помощью RAD140 частично происходит через AR-опосредованное снижение мРНК ESR1 и последующее подавление ER-сигнального пути, независимо от изменений ESR1. В моделях эндокринно-независимого рака молочной железы in vitro и in vivo изучили линии HCC1428 с длительным лишением эстрогена (LTED) и HCC1428-LTED-резистентная к палбоциклибу (-palboR). Эндокринно-независимая модель PDX изучена на мышах без дополнительного эстрадиола. Предшествующая противораковая терапия пациентов-доноров ксенотрансплантатов включала тамоксифен, эксеместан, фулвестрант и несколько линий химиотерапии. RAD140 (3 мг/кг дважды в день), элацестрант (30 мг/кг один раз в день) и палбоциклиб (10 мг/кг один раз в день) вводились мышам перорально в течение всего периода исследования. Фулвестрант (3 мг/мышь) – один раз в неделю подкожно. В гормононезависимой модели PDX, содержащей мутацию ESR1 D538G, лечение RAD140 привело к ингибированию роста опухоли на 80% (TGI) по сравнению с плацебо. Селективный разрушитель ER (SERD) фулвестрант показал TGI 7%, а пероральный SERD элацестранта – 60%. Комбинация RAD140 с элацестрантом продемонстрировала более высокую противоопухолевую активность, чем каждый из препаратов в отдельности (93% TGI). Эти данные экспериментов in vivo свидетельствуют о том, что активность ER-нацеленного RAD140 может быть опосредована не только механизмами ингибирования ER-сигнализации. В двух гормононезависимых моделях клеточных линий AR+/ER+, HCC1428-LTED и HCC1428-LTED-palboR после длительного лечения (две недели) в дозе 100 нМ RAD140 вызвал морфологические изменения, связанные с апоптозом, наряду с увеличением числа аннексин V/PI-позитивных клеток. По результатам вестерн-блот анализа это также подтверждалось увеличением количества расщепленных белков PARP/caspase3/caspase7. Также происходило снижение уровня регулятора апоптоза – белка BCL-2. Эти результаты в совокупности свидетельствуют о том, что RAD140 индуцирует апоптоз в эндокринорезистентных клетках рака. В клетках, обработанных RAD140, происходило увеличение фосфо-H2A.X, чувствительного маркера повреждения ДНК. Аналогичные изменения наблюдались с положительным контролем AR-агониста – дигидротестостероном, но не с фулвестрантом. Антагонист AR апалутамид частично отменял апоптоз, индуцированный RAD140 и дигидротестостероном, что еще больше подтверждает наличие предполагаемого противоракового эффекта.
Клинические испытания
На сегодняшний день завершено единственное клиническое исследование фазы 1 по оценке эффективности и безопасности Radarine (NCT03088527). В испытаниях по переносимости, фармакокинетике и клинической активности препарата принимали участие двадцать женщин с гормон-рецептор-положительный (HR+) раком груди, находящиеся в постменопаузе [7]. Основными критериями отбора являлись: ER+/HER2- и неоперабельный/метастатический РМЖ, постменопаузальный период и непригодность к получению стандартной терапии [8]. Последовательное повышение дозы было запланировано таким образом, чтобы пациенты получали RAD140 по стандартной схеме 3+3 с несколькими 28-дневными циклами дозирования. Начальная доза, 50 мг/день, перорально, была выбрана на основе человеческой эквивалентной дозы (HED), равной эффективной дозе 10 мг/кг, наблюдавшейся на PDX-моделях рака молочной железы HR+ [5]. Фармакокинетическая характеристика и оценка фармакодинамики до и после лечения включала исследование биомаркеров статуса гормональных рецепторов ER, PR и AR и индекса пролиферации Ki67 с помощью иммуногистохимии, сбора образцов крови для определение PSA, SHBG и анализ ктДНК, отбор биоптатов. Первичной целью являлась оценка безопасности и определение максимально переносимой дозы (МТД); вторичными целями были фармакокинетика и противоопухолевая активность. Основными критериями отбора стали: ER+/HER2- и неоперабельный/метастатический РМЖ (mBC), постменопаузальный период и непригодность к стандартной терапии. Статус ER определяется с помощью иммуногистохимии. Глобулин, связывающий половые гормоны (SHBG), и простатспецифический антиген (PSA) в сыворотке крови используются для оценки AR-активности.
В конце 2019 года были опубликованы некоторые результаты NCT03088527 [8]. Эскалация дозы была завершена на 16 пациентках, средний возраст составлял 58 лет, 88% имели висцеральные заболевания, 94% – AR+ по иммуногистохимическим данным. Предшествующие варианты терапии включали фулвестрант (88%), ингибитор ароматазы – 100%, CDK4/6i – 94%, mTORi/PI3Ki – 50%, химиотерапия – 94%. Дозы RAD140 составляли 50 мг (n = 6), 100 мг (n = 7) и 150 мг (n = 3) в сутки. Медиана времени лечения – 8 недель. Наиболее частыми (>30%) нежелательными явлениями были повышение уровня ALT/AST, снижение веса или аппетита и запоры. Ограничивающими дозу токсическими явлениями, бывшими класса 3 и обратимыми, оказались гипофосфатемия (n = 2; 150 мг) и повышение ALT/AST (n = 2; 50 и 100 мг). Смертей, связанных с приемом препарата, не было. Был отмечен 1 частичный ответ (100 мг) и 2 пациента со стабильным течением заболевания ≥12 недель. Время до частичного ответа составило 15,9 недель, а продолжительность – 8,6+ недель. SHBG снизился у 12/12 пациентов, а PSA повысился у 10/14 пациентов, что особенно заметно у женщины с частичным ответом, которая продолжила лечение через семь месяцев. Максимально переносимую дозу установили на уровне 100 мг Radarine.
Образцы крови, собранные в течение 144 часов после однократного приема 100 мг, показали переменную абсорбцию с периодом полураспада около 60 часов [9]. Наблюдаемое постоянное воздействие на человека в дозе 100 мг превышает действие эффективной дозы в 10 мг/кг на мышах. Из 9 оцениваемых пациентов при 100 мг наблюдался 1 частичный ответ и 3 пациента (33%) со стабильным течением заболевания ≥12 недель. Время до частичного ответа составило 15,9 недель при продолжительности 18,6+ недель. Три пациента продолжили лечение. SHBG снизился у 18/18 пациентов, а PSA увеличился у 15/20 пациентов с парными образцами, что свидетельствует о задействовании AR-мишени. У одного пациента с парными биопсиями опухоли до и во время лечения по результатам иммуногистохимического анализа наблюдалась сильная индукция AR, преимущественно в ядре, что свидетельствует об активации AR под действием RAD140 на тканевом уровне. RAD140 продемонстрировал приемлемый профиль безопасности и предварительные доказательства активации мишени и противоопухолевой активности [9]. Остальные результаты фазы 1 к настоящему моменту не опубликованы.
Следует отметить, что исследование NCT03088527 не включало конечные точки, связанные с изменением соотношения безжировой и жировой массы тела и физических функций.
RAD140 в бодибилдинге
Агонистическое действие Radarine на андрогенный рецептор, описанное в экспериментах на животных, привлекло к препарату внимание спортсменов и любителей бодибилдинга. И хотя данные по безопасности и эффективности Radarine при использовании человеком весьма ограничены, его используют для «сушки», похудания и набора мышечной массы. Диапазон дозировок Radarine зависит от веса тренирующегося человека и составляет 5–30 мг/сутки за два приема, продолжительность 8–16 недель, затем перерыв 6–8 недель [10]. Некоторые спортсмены сочетают Radarine с другими SARMs или анаболическими стероидами. Также RAD140 приписывают способность улучшать «результаты в постели» и качество сна, а также повышать настроение.
Некоторые производители пищевых добавок незаконно добавляют RAD140 и другие SARMs в свои продукты; эти вещества можно обнаружить методом хромато-масс-спектрометрии [11]. RAD140 внесен ВАДА в список субстанций, запрещенных как в соревновательный, так и во внесоревновательный период [12].
Неконтролируемое использование Radarine вызывает серьезные опасения [13]. В одном из недавних отчетов описано значительное поражение печени у 49-летнего мужчины, принимавшего препарат четыре недели (доза не сообщается), поступившего в клинику с желтухой и зудом продолжительностью пять недель [14]. Повышение уровня билирубина, AST, ALT и креатинина указывало на смешанное гепатоцеллюлярно-холестатическое поражение печени. Гистология печени также выявила воспаление. Билирубин достиг пика в 346 мкмоль/л. Однако все печеночные тесты полностью нормализовались через 12 месяцев после его первоначальной госпитализации.
Другой клинический случай описывает здорового 24-летнего мужчину азиатской внешности, который поступил в отделение неотложной помощи с двухнедельной историей диффузных болей в животе, желтухи, желтизны склер и ухудшающегося зуда [15]. Он не принимал никаких лекарств по рецепту и не употреблял рекреационные наркотики или алкоголь. Единственным безрецептурным препаратом был RAD-140, который пациент использовал в течение пяти недель и прекратил прием за две недели до поступления в клинику из-за повышенного уровня печеночных ферментов, отмеченного при рутинных лабораторных анализах. Обследование было неполным, так как мужчина ушел вопреки рекомендациям врача. Через три недели он был госпитализирован с ухудшением желтухи и зудом. Первоначальная картина гепатоцеллюлярного повреждения впоследствии сменилась значительным холестазом с пиком общего билирубина примерно на 11-ой неделе после начала приема RAD-140. Оценка острых и хронических заболеваний печени не выявила патологий. Несмотря на умеренно повышенную щелочную фосфатазу, гамма-глутамилтранспептидаза оставалась в норме. Ферритин был значительно повышен – 1523 нг/мл, но насыщение трансферрина было нормальным. Токсикологический анализ мочи на наркотики также был отрицательным. Визуализация печени выявила гепатомегалию и некоторые очаговые жировые инфильтраты, но исключила билиарную или сосудистую обструкцию. Биопсия печени выявила пустой каналикулярный холестаз без выраженного воспаления, что соответствует внутрипеченочному холестазу, вызванному лекарственными препаратами. Пациент остается бессимптомным с устойчивым улучшением печеночных тестов после прекращения приема RAD-140 в течение последних пяти месяцев.
На форумах спортсменов-любителей, пользующихся допингом, имеются дополнительные непроверенные данные о побочных эффектах, включающих бессонницу, снижение либидо и вялость.
Заключение
В целом, RAD140 обладает всеми признаками SARMs и, как показано на животных моделях, селективен по действию, поскольку стимулирует рост мышечной массы при более низкой дозе, чем та, которая требуется для увеличения веса простаты. Более того, Radarine также селективен по эффективности, так как полностью анаболичен в мышцах, но демонстрирует меньшую активность в простате и семенных пузырьках и, фактически, может частично антагонизировать стимуляцию семенных пузырьков, вызываемую тестостероном. RAD140 имеет отличную фармакокинетику и является мощным анаболиком у нечеловекообразных приматов.
Соединение прошло доклинические токсикологические исследования на крысах и обезьянах, показало антидистрофическую, нейропротекторную и противораковую активность, и в настоящее время исследуется на пациентах как препарат для лечения рака груди. Влияние RAD140 на повреждение ДНК и апоптоз предполагает возможность комбинированной терапии с препаратами, направленными на выживание клеток и пути восстановления повреждений ДНК.
На сегодняшний день не существует утвержденных фармакологических препаратов на основе SARMs для профилактики или лечения мышечного истощения, хотя существует неудовлетворенная клиническая потребность в безопасных и эффективных анаболических средствах. Несмотря на эффект, продемонстрированный RAD140 в доклинических испытаниях, результаты по улучшению мышечной силы и физической функции у человека все еще отсутствуют, как и данные о безопасности долгосрочного применения. Однако RAD140 нелегально применяется спортсменами как допинг, что может приводить к негативным для здоровья последствиям. Клинические случаи значительных нарушений работы печени, вызванные RAD-140, вызывают опасения относительно селективности и безопасности.
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
Реверол, Рекардин и другие лиганды рецептора REV-ERB. При дистрофии и для регенерации мышц
No post found!
Ибутаморен (Ibutamoren, MK-677)
Таблетки – заменители физических упражнений
1. Solomon, Z.J., Mirabal, J.R., Mazur, D.J., Kohn, T.P., Lipshultz, L.I., Pastuszak, A.W., Selective Androgen Receptor Modulators: Current Knowledge and Clinical Applications. Sex Med Rev, 2019. 7(1): p. 84-94. DOI: 10.1016/j.sxmr.2018.09.006.
2. Miller, C.P., Shomali, M., Lyttle, C.R., O’Dea, L.S.L., Herendeen, H., Gallacher, K., Paquin, D., Compton, D.R., Sahoo, B., Kerrigan, S.A., Burge, M.S., Nickels, M., Green, J.L., Katzenellenbogen, J.A., Tchesnokov, A., Hattersley, G., Design, Synthesis, and Preclinical Characterization of the Selective Androgen Receptor Modulator (SARM) RAD140. ACS Medicinal Chemistry Letters, 2011. 2(2): p. 124-129. DOI: 10.1021/ml1002508.
3. Jayaraman, A., Christensen, A., Moser, V.A., Vest, R.S., Miller, C.P., Hattersley, G., Pike, C.J., Selective androgen receptor modulator RAD140 is neuroprotective in cultured neurons and kainate-lesioned male rats. Endocrinology, 2014. 155(4): p. 1398-1406. DOI: 10.1210/en.2013-1725.
4. Jahan, N., Jones, C., Rahman, R.L., Androgen receptor expression in breast cancer: Implications on prognosis and treatment, a brief review. Molecular and Cellular Endocrinology, 2021. 531: p. 111324. DOI: https://doi.org/10.1016/j.mce.2021.111324.
5. Yu, Z., He, S., Wang, D., Patel, H.K., Miller, C.P., Brown, J.L., Hattersley, G., Saeh, J.C., Selective Androgen Receptor Modulator RAD140 Inhibits the Growth of Androgen/Estrogen Receptor–Positive Breast Cancer Models with a Distinct Mechanism of Action. Clinical Cancer Research, 2017. 23(24): p. 7608. DOI: 10.1158/1078-0432.CCR-17-0670.
6. He, S., Conlan, M.G., Arlt, H., Morris, C., Yu, Z., Abstract P5-05-01: Novel mechanisms of action of selective androgen receptor modulator RAD140 in AR+/ER+ breast cancer models. 2020, AACR.
7. Hamilton, E., Vidula, N., Ma, C., LoRusso, P., Saeh, J., Reichert, V., Yu, Z., Annett, M., Weitzman, A., Hattersly, G., Neill, A., Weise, A., Abstract OT1-02-02: A phase 1, first-in-human, multi-part study of RAD140, an oral nonsteroidal selective androgen receptor modulator, in postmenopausal women with hormone receptor positive breast cancer. Cancer Research, 2019. 79(4 Supplement): p. OT1-02-02. DOI: 10.1158/1538-7445.SABCS18-OT1-02-02.
8. Hamilton, E., Vidula, N., Ma, C., LoRusso, P., Bagley, R.G., Yu, Z., Annett, M., Weitzman, A., Conlan, M.G., Weise, A., 343P — Phase I dose escalation study of a selective androgen receptor modulator RAD140 in estrogen receptor positive (ER+), HER2 negative (HER2-) breast cancer (BC). Annals of Oncology, 2019. 30: p. v123. DOI: https://doi.org/10.1093/annonc/mdz242.038.
9. Hamilton, E., LoRusso, P., Ma, C., Vidula, N., Bagley, R.G., Troy, S., Annett, M., Yu, Z., Weitzman, A., Conlan, M.G., Abstract P5-11-01: Phase 1 dose escalation study of a novel selective androgen receptor modulator (SARM), RAD140, in estrogen receptor positive (ER+), human epidermal growth factor receptor 2 negative (HER2-), metastatic breast cancer. 2020, AACR.
10. Testolone (RAD140). 2018; Available from: http://www.psychonomic-journals.org/testolone-rad140-review/.
11. Temerdashev, A.Z., Azaryan, A.A., Labutin, A.V., Dikunets, M.A., Zvereva, I.O., Podol’skii, I.I., Berodze, G.T., Balabaev, I.A., Application of chromatography–mass spectrometry methods to the control of sport nutrition and medicines marketed via internet. Journal of Analytical Chemistry, 2017. 72(11): p. 1184-1192. DOI: 10.1134/S1061934817110090.
12. Международный Стандарт: Кодекс, Всемирный Антидопинговый. Приложение 1. Запрещенный список. 2020; Available from: https://rusada.ru/upload/iblock/06d/%D0%97%D0%B0%D0%BF%D1%80%D0%B5%D1%89%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9%20%D1%81%D0%BF%D0%B8%D1%81%D0%BE%D0%BA%202020.pdf.
13. Burmeister, M.A., Fincher, T.K., Recreational Use of Selective Androgen Receptor Modulators. US Pharm, 2020. 45(60): p. 15-18.
14. Flores, J.E., Chitturi, S., Walker, S., Drug-Induced Liver Injury by Selective Androgenic Receptor Modulators. Hepatology Communications, 2020. 4(3): p. 450-452. DOI: https://doi.org/10.1002/hep4.1456.
15. Yaramada, P., Goyal, P., Hammami, M., Cai, C., S2399 RAD-140: An Emerging Cause of Drug-Induced Liver Injury. Official journal of the American College of Gastroenterology | ACG, 2020. 115.