Рецептор REV-ERB, регулирует ключевые процессы в организме – сон, суточные ритмы и регенерацию мышц. Лиганды рецептора могут действовать как его агонисты или антагонисты, вызывая ответную физиологическую реакцию. Агонисты могут стимулировать регенерацию мышц после травмы или при дистрофических процессах (мышечная дистрофия Дюшенна и болезнь Альцгеймера), повышают плотность костей, регулируют циркадные ритмы и оказывают противовоспалительное действие; антагонисты – способствуют увеличению безжировой мышечной массы и работоспособности. В обзоре рассмотрены Рекардин (Recardin, SR9011), Реверол (Reverol, SR9009), SR8278, GSK4112 и другие лиганды рецептора REV-ERB.
Агонисты и антагонисты REV-ERB
Рецептор REV-ERB, локализованный в клеточном ядре, регулирует многие ключевые процессы в организме – от сна и суточных ритмов до уровня холестерина и, как было обнаружено в последнее десятилетие, регенерации мышц. REV-ERB играет уникальную роль на каждой стадии развития мышечной ткани. Мышечные стволовые клетки, способствующие замене поврежденной ткани, производят миобласты, которые либо воспроизводятся (размножаются), либо формируют мышечную ткань (дифференцируются). Снижение экспрессии REV-ERB приводит к дифференцировке миобластов. Напротив, увеличение образования REV-ERB участвует в регуляции митохондриальной и метаболической функции полностью дифференцированных скелетных мышц; действуя на рецептор веществами-агонистами можно стимулировать регенерацию мышц после острой травмы или при дистрофических процессах, таких как мышечная дистрофия Дюшенна (МДД) и болезнь Альцгеймера. REV-ERBα и REV-ERBβ являются необычными членами семейства ядерных рецепторов REV-ERB, которые проявляют лиганд-зависимую активность, благодаря чему можно тонко регулировать протекание процессов в организме.
МДД – это смертельная форма мышечной атрофии, которая поражает одного из 5 –10 тысяч мальчиков. Заболевание вызвано мутациями в гене X-хромосомы. При лечении люди с МДД в среднем живут около 25 лет. Мальчики с этим заболеванием к 12 годам обычно нуждаются в инвалидной коляске и в искусственной вентиляции легких для облегчения дыхания. Многие в конечном итоге страдают сердечной или дыхательной недостаточностью. МДД характеризуется отсутствием белка дистрофина, что приводит к чрезмерному повреждению нормальной ткани и ведет к продолжающимся циклам разрушения и регенерации мышц, которые способствуют воспалению, фиброзу (рубцеванию) и потере функции скелетных и сердечных мышц. Клинически МДД лечат глюкокортикоидами, которые замедляют потерю двигательной функции и метаболизм в мышцах, возможно, путем подавления фиброза. Ряд методов лечения, которые в настоящее время исследуются, выглядят многообещающими, но преимущественно работают только для сдерживания прогрессирования заболевания. По-прежнему остаются необходимыми безопасные фармакологические методы лечения, которые борются с истощением мышц и фиброзом.
В 2008 году был обнаружен первый синтетический лиганд REV-ERBα – GSK4112 [1]. В экспериментах in vitro на фибробластах вещество индуцировало фазозависимые двунаправленные сдвиги биохимических циркадных ритмов. Эти результаты стали отправной точкой для поиска новых лигандов рецептора REV-ERB.
GSK4112
GSK4112 (SR6452, {1,1-диметилэтил-N-[(4-хлорфенил)метил]-N-[(5-нитро-2-тиенил) метил]глицинат}; CAS 1216744-19-2)
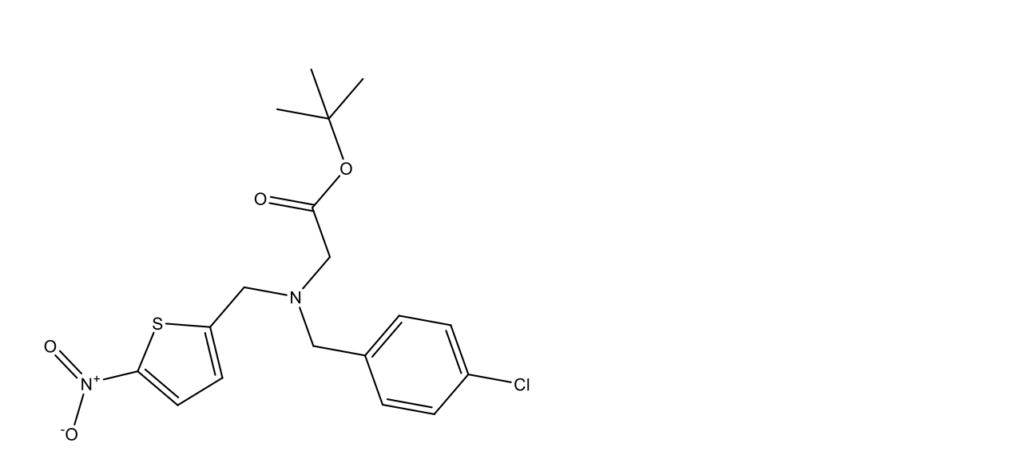
GSK-4112 – экспериментальный агонист REV-ERBα, открытый компанией GlaxoSmithKline [1]. Данный синтетический препарат предназначен для изучения возможностей регуляции циркадного ритма, а также влияния на адипогенез (образование жировых клеток, адипоцитов, из стволовых) [2, 3], плотность костей [4] и воспалительные процессы [5, 6].
В работе [1] было определено значение полуэффективной максимальной концентрации (EC50) 250 нМ для GSK-4112, который подавлял активность ингибитора активатора плазминогена-1 Pai1 на 30%. Также было показано, что благодаря изменению уровня экспрессии рецептора REV-ERBα в соответствии с биохимическим циркадным ритмом клеток, эффективность лиганда будет варьироваться в зависимости от фазы цикла. Этот препарат действует поэтапно на основные молекулярные часы как в клеточных линиях, так и в первичных тканях.
Поскольку рецепторы REV-ERB наиболее распространены в печени, жировой ткани, скелетных мышцах и головном мозге, они являются ключевыми регуляторами циркадного ритма. Действие GSK-4112 означает, что фармакологическое воздействие на рецептор предлагает новые способы лечения метаболических заболеваний. REV-ERBα участвует в адипогенезе [2]. Уровни мРНК REV-ERB высоки в раннем адипогенезе (день 0), затем экспрессия снижается в промежуточном адипогенезе (день 1–3) и снова повышается в позднем (день 4+). Интересно, что уровни белка REV-ERB не отражают профиль экспрессии мРНК, а скорее показывают противоположный характер – они высоки в течение 1–3 дней и снижаются в конце адипогенеза. GSK-4112 функционирует как синтетический агонист, который имитирует действие гема (порфириновый комплекс с Fe2+) во время адипогенеза. Гем является эндогенным лигандом рецептора [7]. GSK-4112 может быть полезен при лечении заболеваний, связанных с ожирением, включая нарушения обмена веществ.
REV-ERBα отрицательно регулирует дифференциацию остеокластов и остеобластов [4]. Внутрибрюшинное введение мышам агониста GSK-4112 защищает от потери костной массы, вызванной RANKL (лиганд ядерного фактора-κB), путем ингибирования дифференцировки остеокластов in vivo, т. е., клеток, которые удаляют костную ткань, растворяя минеральную составляющую и разрушая коллаген. В концентрации 30 нМ GSK-4112 снижает жизнеспособность этих клеток с 0,4 до 0,35. В эксперименте in vivo мышам внутрибрюшинно вводили солевой буфер или RANKL (1 мг/кг), с GSK-4112 или без него (5 мг/кг в день в течение четырех дней) и умерщвляли на пятый день. Длинные кости, полученные от мышей, подвергали анализу. Объем костной ткани снизился на 10% без GSK-4112 под действием RANKL, и лишь на 3–4% – при использовании препарата. Отделимость губчатой костной ткани выросла на ~50 против ~10–15 мкМ c GSK-4112. Результаты демонстрируют молекулярный механизм постепенного уменьшения интенсивности ремоделирования кости и обеспечивают основу для разработки потенциальной терапевтической мишени для лечения заболеваний костей, характеризующихся чрезмерной резорбцией ткани.
Данные показывают, что REV-ERBα также играет важную регулирующую роль в зависимой от ритмов физиологии легких и в воспалительном ответе. В работе [5] предположили, что воздействие сигаретного дыма влияет на REV-ERBα в легких, способствуя провоспалительному фенотипу рецептора. Чтобы определить влияние активации REV-ERBα на вызванный дымом воспалительный ответ, первичные эпителиальные клетки малых дыхательных путей человека (SAEC) обрабатывали экстрактом сигаретного дыма (0.25%) или липополисахаридом (LPS, 1 мкг/мл) в отсутствие или в присутствии предварительной обработки агонистом GSK-4112 (20 мкМ/мл в течение 2 или 6 часов) in vitro. Авторы также подвергали взрослых REV-ERBα-дефицитных мышей (10 и 30 дней) действию сигаретного дыма in vivo и измеряли высвобождение провоспалительных цитокинов. Данные показывают, что предварительная обработка GSK-4112 снижает индуцированное высвобождение провоспалительных цитокинов как в SAEC, так и в фибробластах легких мыши (MLF). Уровни IL-6 были в три раза ниже в SAEC, чем без применения GSK-4112, IL-8 – в два; для MLF разница IL-6 превышала десятикратную. Кроме того, REV-ERBα-дефицитные мыши демонстрируют больший воспалительный ответ на 10 и 30 дней действия сигаретного дыма, включая увеличение притока нейтрофилов в легкие, высвобождение провоспалительных цитокинов (IL-6, MCP-1 и KC) по сравнению с нормальными мышами. Эти данные демонстрируют, что REV-ERBα является важным регулятором воспалительных реакций легких, вызванных попаданием сигаретного дыма.
Стимуляция ядерных рецепторов REV-ERB подавляет выработку проноцицептивных молекул, вызывающих боль в периферических нервных рецепторах, в культивируемых спинальных астроцитах и снижает механическую гиперчувствительность воспалительной и нейропатической боли у мышей [6]. Инкубация культивированных спинальных астроцитов только с 20 мкМ GSK4112 не оказывала значительного влияния на экспрессию мРНК проноцицептивных молекул. У мышей, получавших LPS, интратекально (в спинномозговой канал) вводили 100 нмоль GSK4112 за 1 час до инъекции LPS. Мыши, обработанные иммуностимулятором CFA, через неделю после интраплантарного введения CFA получали интратекальные инъекции 100 нмоль GSK4112. Затем авторы измеряли пороги отмены через 1–24 часа после введения. Предварительная интратекальная обработка GSK4112 (100 нмоль) предотвратила возникновение механической гиперчувствительности, вызванной LPS. Уровень воспалительного IL-6 был на 40% ниже, чем в контроле; IL-1β – на ~50%.
SR8278
SR8278 (этил 2-(5-метилсульфанилтиофен-2-карбонил)-3,4-дигидро-1H-изохинолин-3-карбоксилат; CAS 1254944-66-5)
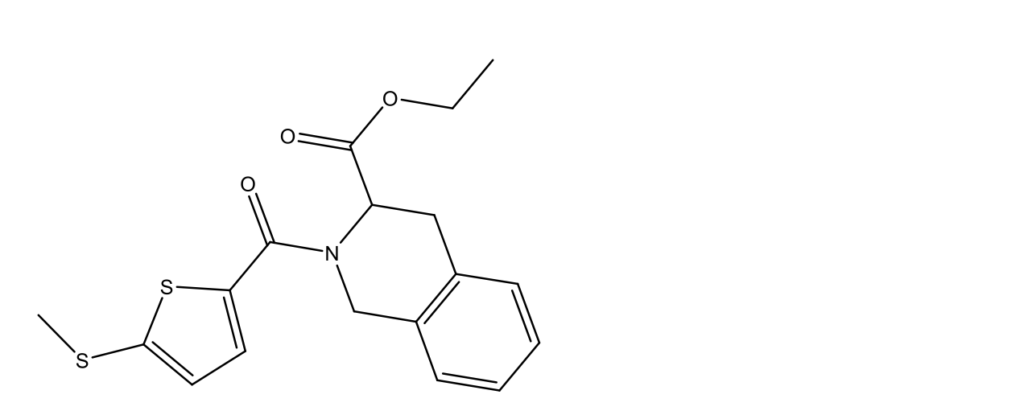
SR8278 – первое экспериментальное соединение, являющееся антагонистом рецептора REV-ERBAα, синтезированное в 2011 году в американском некоммерческом медицинском исследовательском центре Scripps Research (ранее известном как The Scripps Research Institute) [8]. SR8278 структурно подобен агонисту GSK4112, но блокирует способность GSK4112 усиливать REV-ERBα-зависимую репрессию при котрансфекции клеток HEK293, тогда как GSK4112 подавляет экспрессию генов-мишеней REV-ERBα, участвующих в глюконеогенезе, SR8278 стимулирует экспрессию этих генов. SR8278 был использован для демонстрации потенциального применения антагонистов REV-ERBAα при лечении таких состояний, как мышечная дистрофия Дюшенна и болезнь Альцгеймера [9, 10].
Исследователи из Медицинской школы Университета Сент-Луиса поставили задачу определить, может ли изменение активности REV-ERB с использованием антагониста REV-ERB SR8278 быть полезным в модели МДД у мышей-дистрофов [9]. Авторы показали, что лечение SR8278 привело к увеличению безжировой мышечной массы и улучшению мышечной функции, что было проверено с помощью оценки силы захвата на мышах с МДД. Безжировая мышечная масса через 5–6 недель составляла 5–6% после курса SR8278 по 25 мг/кг ежедневно путем подкожных инъекций в течение шести недель против 2–2,5%в контроле. Общая масса тела мышей, получавших SR8278 в течение шести недель незначительно отличалась от контрольной группы. Сила мышц в экспериментальной группе составила ~2 N против 1,8 N в контроле. Исследователи также продемонстрировали, что SR8278 стабилизировал скелетные мышцы у этих мышей без какой-либо явной токсичности. Также было показано, что SR8278 улучшает архитектуру мышц и снижает фиброз у мышей с МДД. Авторы обнаружили, что антагонизм к REV-ERB приводит к увеличению факторов, участвующих в миогенезе (формировании мышечной ткани), что приводит к стабилизации безжировой мышечной массы. Исследователи показали, что лечение SR8278 привело к увеличению производства митохондрий. Антагонистическое действие SR8278 на REV-ERB регулирует передачу сигналов Wnt, что объясняет то, как SR8278 способствует регенерации мышц и улучшает мышечную функцию.
REV-ERB совместно регулирует регенерацию мышц посредством связанного взаимодействия с цистромом NF-Y в модели повреждения, вызванного кардиотоксином (CTX) [11]. CTX-повреждение было индуцировано у мышей путем инъекции 30 мл CTX (10 мМ) в три точки передней большеберцовой мышцы левой задней конечности для образования однородного повреждения мышцы. Мышам вводили антагонист SR8278 (25 мг/кг) путем подкожной инъекции или солевой буфер в качестве контроля. Животных умерщвляли на 8 и 15 день после CTX-повреждения. На восьмой день активность миогенных генов возросла в 1,5 раза, и поддерживалась на уровне 1,2–1,3 раза выше относительно контроля. Эти результаты показывают, что антагонизм REV-ERB дополнительно активирует промиогенные программы в ответ на повреждение мышц. Эффекты SR8278 в поврежденной и неповрежденной мышце подразумевают, что активность препарата может способствовать развитию миогенных программ исключительно в пролиферативной среде поврежденной мышцы.
Recardin
Recardin (Рекардин, SR9011, 3-({(4-хлорбензил)[(5-нитротиофен-2-ил)метил]амино}метил)-N-пентилпирролидин-1-карбоксамид; CAS 1379686-29-9)
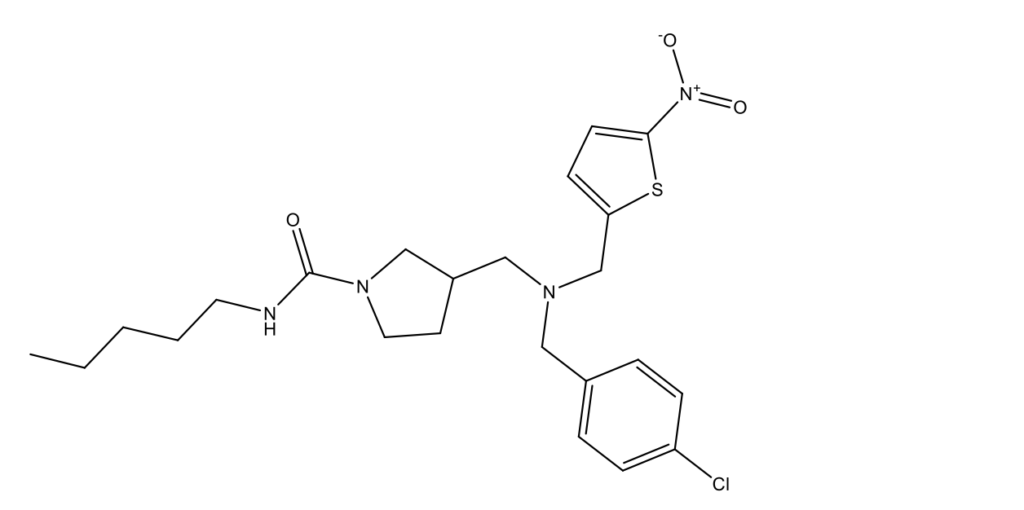
Recardin представляет собой исследовательский препарат, разработанный в 2012 году в исследовательском центре Scripps Research в качестве агониста REV-ERBAα, члена семейства рецепторов REV-ERBA. По отношению к REV-ERBα полумаксимальная ингибирующая концентрация IC50= 790 нМ и IC50=560 нМ – к REV-ERBAβ [12, 13]. Recardin в концентрации 5 мкМ влияет на иммунный ответ и ослабляет экспрессию провоспалительных цитокинов и снижает клеточный метаболизм в микроглии in vitro [14].
Ученые исследовали метаболические эффекты Recardin в дозировке 100 мг/кг, внутрибрюшинно, два раза в день в течение 12 дней, используя комплексную систему мониторинга лабораторных животных [12]. Мышам вводили Recardin дважды в день в течение 10 дней. Наблюдалось увеличение потребления кислорода на 5%, что указывает на увеличение расхода энергии в дневной и ночной фазах, однако не было связано с повышенной активностью, так как мыши показали снижение подвижности на 15%. Также было отмечено 10%-ное увеличение потребления пищи в ночное время. В соответствии с повышенной скоростью метаболизма, наблюдалось уменьшение жировой массы при применении Recardin на 1,5%.
Recardin (100 мг/кг, внутрибрюшинно, два раза в день, 3–10 дней) может регулировать архитектуру сна и эмоциональное поведение мышей: агонисты REV-ERB способствуют бодрствованию и уменьшают фазу быстрого и медленного сна [15]. Интересно, что также снижается тревожное поведение животных.
В экспериментах на мышиной модели было показано, что Recardin регулирует регенерацию поврежденных мышц (доклиническое исследование in vitro на мышиных и человеческих миобластах с 5 мкМ препарата) [11]. Recardin демонстрирует потенциал для лечения легочной гипертонии, что показано на крысах при дозе 50 мг/кг, внутрибрюшинно, в течение двух недель [16]. Лечение было связано с нормализацией гемодинамики, обратным ремоделированием сосудов (31,42% против 49,28% в контроле), уменьшилась пролиферация и гипертрофия правого желудочка.
В 2016 году стало понятно, что Recardin может найти применение в качестве допинга, и поэтому были разработаны методы его выявления [17]. Предел обнаружения в моче составляет 5 нг/мл [18]. Как и предполагалось ранее, сейчас препарат неофициально продается в интернет-магазинах. По данным интернет-источникам и форумам спортсмены используют его для уменьшения жировой массы и улучшения рельефа мышц в дозах 15–30 мг/день в два приема курсами по 2–3 месяца.
Reverol
Reverol (Реверол, Stenabolic, SR9009, Plavix, этил-3-({(4-хлорбензил)[(5-нитротиофен-2-ил)метил]амино}метил)пирролидин-1-карбоксилат); CAS 1379686-30-2)
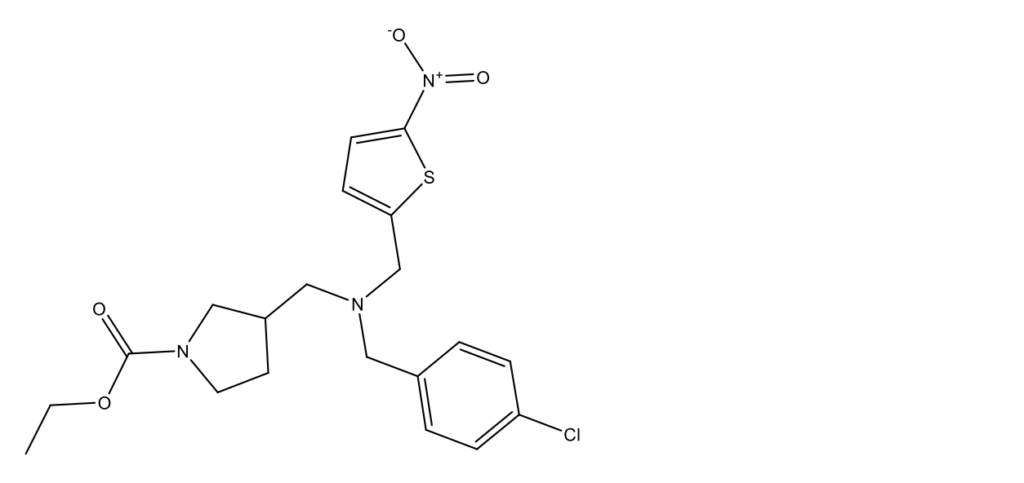
Reverol, как и Recardin, – агонист REV-ERBAα, продукт разработки медицинского исследовательского центра Scripps Research; оба препарата имеют близкие структуры [12, 13]. Для REV-ERBAα IC50= 670 нМ и для REV-ERBAβ IC50= 800 нМ.
Метаболические эффекты Reverol в тех же условиях похожи на действие Recardin (100 мг/кг, внутрибрюшинно, два раза в день в течение 12 дней) [12]. Будучи лигандом рецептора REV-ERB, Reverol изменяет физиологическое время суток у мышей, и может быть полезен для лечения нарушений сна.
В других исследованиях также отмечают чрезвычайно близкие свойства Reverol и Recardin при одинаковых условиях проведения эксперимента [15]. Однако позже были обнаружены и специфические эффекты Reverol. Как оказалось, препарат способен проявлять действие, не опосредованное взаимодействием с REV-ERB, оказывая сильное влияние на жизнеспособность клеток, метаболизм и экспрессию генов при генетическом отсутствии REV-ERB у мышей с выключенным геном рецептора [19]. Reverol вызывает серьезное снижение митохондриального дыхания и набухание митохондрий.
Исследование [20] показало, что Reverol модулирует окислительную способность скелетных мышц, регулируя митохондриальный биогенез и аутофагию. Фармакологическая активация REV-ERBAα при действии на мышей синтетическим лигандом Reverol влияло на способность к физической нагрузке: в тесте на выносливость мыши, получавшие препарат, бегали значительно дольше как по времени, на 20–22 минуты, так и по расстоянию, на 500 метров, чем мыши из контрольной группы. Специфическая для скелетных мышц избыточная экспрессия REV-ERB-α у мышей значительно улучшила функцию митохондрий, о чем свидетельствует значительное усиление стимулированного глутаматом и управляемого АДФ клеточного дыхания [20]. Эти данные указывают на то, что Reverol оказывает благотворное влияние на скелетные мышцы, улучшая митохондриальное дыхание и работоспособность.
Кроме того, Reverol снижает синтез липидов, холестерина и желчной кислоты в печени и снижает запасы жира в белой жировой ткани в экспериментах in vitro и in vivo [21]. Подобно препарату Recardin, вызывает опасение использования Reverol как допинг-препарата [17, 18]. Отметим, что его предел обнаружения оказался несколько ниже – 2 нг/мл против 5 нг/мл в случае Recardin [18] и он внесен в Список запрещенных веществ ВАДА [22]. Нелегальные потребители препарата нашили ему применение в качестве «жиросжигателя» и употребляют по 10 мг три раза (но не превышая суточной дозы 30 мг) в день курсом до трех месяцев.
Стимуляция ядерных рецепторов REV-ERB подавляет выработку вызывающих боль проноцицептивных молекул в культивируемых спинальных астроцитах и снижает механическую гиперчувствительность воспалительной и нейропатической боли у мышей [6]. Мышам, получавшим липополисахарид (LPS, 1 мкг/мл) или CFA интратекально вводили 100 или 300 нмоль Reverol за час до инъекции и через семь дней после введения токсинов. Животные с частичной перевязкой седалищного нерва (PSNL) или после инъекции паклитаксела через 14 дней после вмешательства получали интратекально по 100 или 300 нмоль Reverol. Пороги отмены были измерены через 1, 2, 3, 6 и 24 часа после второй дозы. Обработка SR9009 блокировала увеличение уровней воспалительных факторов IL-1β и IL-6, проноцицептивной активности MMP-9 и механическую гиперчувствительность у подопытных животных. Таким образом, спинномозговые рецепторы REV-ERB могут быть эффективной терапевтической мишенью при лечении хронической боли.
SR12418
SR12418 ((S)-(3-((4-(трет-бутокси)фенокси)метил)-6-фтор-3,4-дигидроизохинолин-2(1H)-ил) (нафталил-1)метанон)
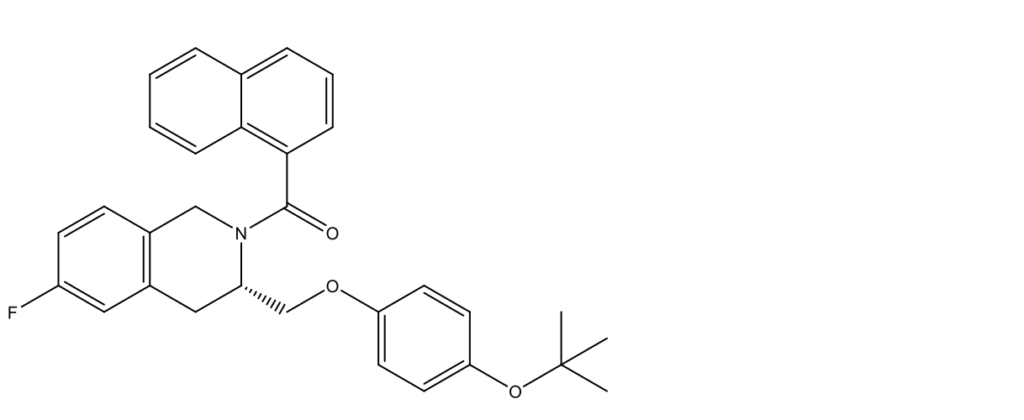
SR12418 – новый REV-ERB-специфический синтетический лиганд полученный путем модификации химической структуры Reverol (SR9009) [23]. SR12418 связывается с REV-ERB и эффективно подавляет активность репортера Bmal1-люциферазы с IC50 менее одной десятой от такового для SR9009 (68 нМ для SR12418 и 710 нМ для SR9009). SR12418 более эффективен, чем SR9009, в ингибировании генов-мишеней REV-ERB, таких как IL-17. Более того, SR12418 обладает лучшими фармакокинетическими свойствами, чем SR9009. Препарат вводили внутрибрюшинно в дозе 50 мг/кг дважды в день в течение трех недель в качестве in vivo зонда для изучения фармакологического воздействия REV-ERB на экспериментальный энцефаломиелит и колит у мышей через три недели от момента вызывания заболевания [23]. По клинической шкале оценки состояния животных показатели резко улучшились уже через неделю применения SR12418 – с 3 баллов до ~0,3–0,5. Мышечная масса мышей в экспериментальной группе приближалась к 100% от контроля, тогда как животные, не получавшие лечение, теряли до 40% веса.
Другие лиганды
К настоящему времени разработан ряд лигандов рецептора REV-ERB, однако они менее исследованы. GSK2945 также был разработан на основе cnhernehs GSK4112, но демонстрирует более благоприятный фармакокинетический профиль с длительным периодом полураспада не менее 2 часов и биодоступностью при пероральном приеме 23% [13]. Это соединение дозозависимо подавляет управляемую промотором BMAL1 репортерную активность люциферазы в клетках U2OS, предполагая агонистический эффект на REV-ERB. Однако сообщают, что GSK2945 напротив антагонизирует REV-ERBα [24]. GSK2945 также блокирует агонистическую активность GSK4112. Кроме того, исследования демонстрируют, что GSK2945 увеличивает экспрессию мРНК BMAL1 и PEPCK (т.е. двух известных генов-мишеней REV-ERB) в клетках и гепатоцитах HepG2, а также у мышей [24]. В настоящее время неясно, является ли GSK2945 агонистом или антагонистом рецептора REV-ERB. Существует вероятность того, что действие GSK2945 может быть специфичным для клетки или ткани, поскольку на активность REV-ERB могут влиять клеточные микросреды, такие как окислительно-восстановительное состояние, низкомолекулярные газы и типы кофакторов [13]. Модификации связанных с лигандом REV-ERB под действием окислительно-восстановительных условий и газов могут приводить к переключению лиганда [8]. GSK4112 повышает уровень холестерин-7α-гидроксилазы (CYP7A1) и ускоряет метаболизм холестерина in vitro.
ARN5187 напрямую взаимодействует с LBD REV-ERBβ и действует как антагонист рецептора REV-ERB [25]. Кроме того, ARN5187 является ингибитором аутофагии. Применение такого двойного ингибитора может стать эффективной стратегией для выявления цитотоксичности раковых клеток.
В 2018 году разработали новый селективный обратный агонист REV-ERB на основе оксазола – GSK1362 [26]. GSK1362 ингибирует взаимодействия REV-ERBα с пептидами NCoR1 и SMRT2. Он также дозозависимо увеличивает управляемую промотором Bmal1 репортерную активность люциферазы в клетках HEK293. Кроме того, авторы создали модель связывания GSK1362 с REV-ERBα и продемонстрировали, что боковая цепь O-метилэтаноламина имеет решающее значение для активности соединения. GSK1362 репрессирует LPS-индуцированную выработку IL-6 в макрофагах костного мозга, как это делают агонисты REV-ERB, что повышает вероятность возникновения нецелевых эффектов.
Структурно родственные GSK0999, GSK5072 и GSK2667 были идентифицированы вместе с GSK2945 в том же исследовании [13]. Эти три соединения показывают фармакокинетические профили, сходные с таковыми для SR9009 (Reverol). ENA_T5382514, ENA_T5445822 и ENA_T5603164 были идентифицированы как лиганды REV-ERB в крупномасштабном скрининге 29568 различных веществ из библиотеки соединений киевской R&D компании Enamine [27]. ENA_T5382514 и ENA_T5445822 являются агонистами, а ENA_T5603164 – антагонистом рецептора REV-ERB. Однако все три соединения демонстрируют низкую селективность, например, воздействуя с ядерными рецепторами ксенобиотиков.
Заключение
Обширные исследования демонстрируют большую роль REV-ERBα в патологических состояниях, включая местные воспалительные заболевания, нарушения обмена веществ, сердечную недостаточность и рак. Было показано, что лиганды REV-ERBα вызывают потенциально полезные фармакологические эффекты. Несмотря на ряд исследований с положительными результатами на животных моделях (доклинические исследования), не было достигнуто прогресса в отношении перевода синтетических лигандов рецептора REV-ERB в стадию клинических испытаний. Проблемы, связанные с лигандами REV-ERBα включают вопросы безопасности или побочные эффекты, неоптимальную фармакокинетику и различия циркадных механизмов человека и грызунов. Предлагается, что для успешной разработки лекарственных средств, нацеленных на REV-ERB, препараты-кандидаты должны быть нацелены на лечение местных заболеваний, а активное вещество следует вводить местно, предотвращая неблагоприятное воздействие на другие ткани.
Ибутаморен (Ibutamoren, MK-677)
Радарин (Radarine, RAD-140, SARM, САРМ)
Лигандрол (Ligandrol, LGD-4033, SARM,САРМ)
No post found!
САРМс (SARMs): Селективные модуляторы андрогенных рецепторов
Таблетки – заменители физических упражнений
Похожие записи
Дигидрохонокиол-B (DHH-B, Dihydrohonokiol-B): новый анксиолитик
Никотинамид рибозид (Nicotinamide riboside) – стимулятор НАД+
Уролитин А (Urolithin A). Мышечная дистрофия и старение
5-amino-1MQ
Топ препаратов от рака. Тенденции рынка
Лоркасерин: снижение аппетита и лечение ожирения
1. Meng, Q.J., McMaster, A., Beesley, S., Lu, W.Q., Gibbs, J., Parks, D., Collins, J., Farrow, S., Donn, R., Ray, D., Loudon, A., Ligand modulation of REV-ERBalpha function resets the peripheral circadian clock in a phasic manner. J Cell Sci, 2008. 121(Pt 21): p. 3629-3635. DOI: 10.1242/jcs.035048.
2. Kojetin, D.J., Burris, T.P., A Role for Rev-erbα Ligands in the Regulation of Adipogenesis. Current Pharmaceutical Design, 2011. 17(4): p. 320-324. DOI: 10.2174/138161211795164211.
3. Chu, G., Zhou, X., Hu, Y., Shi, S., Yang, G., Rev-erbα Inhibits Proliferation and Promotes Apoptosis of Preadipocytes through the Agonist GSK4112. Int J Mol Sci, 2019. 20(18): p. 4524. DOI: 10.3390/ijms20184524.
4. Kim, K., Kim, J.H., Kim, I., Seong, S., Kim, N., Rev-erbα Negatively Regulates Osteoclast and Osteoblast Differentiation through p38 MAPK Signaling Pathway. Mol Cells, 2020. 43(1): p. 34-47. DOI: 10.14348/molcells.2019.0232.
5. Sundar, I.K., Rashid, K., Sellix, M.T., Rahman, I., The nuclear receptor and clock gene REV-ERBα regulates cigarette smoke-induced lung inflammation. Biochemical and biophysical research communications, 2017. 493(4): p. 1390-1395. DOI: 10.1016/j.bbrc.2017.09.157.
6. Morioka, N., Kodama, K., Tomori, M., Yoshikawa, K., Saeki, M., Nakamura, Y., Zhang, F.F., Hisaoka-Nakashima, K., Nakata, Y., Stimulation of nuclear receptor REV-ERBs suppresses production of pronociceptive molecules in cultured spinal astrocytes and ameliorates mechanical hypersensitivity of inflammatory and neuropathic pain of mice. Brain, behavior, and immunity, 2019. 78: p. 116-130. DOI: 10.1016/j.bbi.2019.01.014.
7. Wang, S., Li, F., Lin, Y., Wu, B., Targeting REV-ERBα for therapeutic purposes: promises and challenges. Theranostics, 2020. 10(9): p. 4168-4182. DOI: 10.7150/thno.43834.
8. Kojetin, D., Wang, Y., Kamenecka, T.M., Burris, T.P., Identification of SR8278, a synthetic antagonist of the nuclear heme receptor REV-ERB. ACS Chem Biol, 2011. 6(2): p. 131-134. DOI: 10.1021/cb1002575.
9. Welch, R.D., Billon, C., Valfort, A.-C., Burris, T.P., Flaveny, C.A., Pharmacological inhibition of REV-ERB stimulates differentiation, inhibits turnover and reduces fibrosis in dystrophic muscle. Scientific Reports, 2017. 7(1): p. 17142. DOI: 10.1038/s41598-017-17496-7.
10. Lee, J., Kim, D.E., Griffin, P., Sheehan, P.W., Kim, D.-H., Musiek, E.S., Yoon, S.-Y., Inhibition of REV-ERBs stimulates microglial amyloid-beta clearance and reduces amyloid plaque deposition in the 5XFAD mouse model of Alzheimer’s disease. Aging Cell, 2020. 19(2): p. e13078-e13078. DOI: 10.1111/acel.13078.
11. Welch, R.D., Guo, C., Sengupta, M., Carpenter, K.J., Stephens, N.A., Arnett, S.A., Meyers, M.J., Sparks, L.M., Smith, S.R., Zhang, J., Burris, T.P., Flaveny, C.A., Rev-Erb co-regulates muscle regeneration via tethered interaction with the NF-Y cistrome. Molecular Metabolism, 2017. 6(7): p. 703-714. DOI: https://doi.org/10.1016/j.molmet.2017.05.001.
12. Solt, L.A., Wang, Y., Banerjee, S., Hughes, T., Kojetin, D.J., Lundasen, T., Shin, Y., Liu, J., Cameron, M.D., Noel, R., Yoo, S.-H., Takahashi, J.S., Butler, A.A., Kamenecka, T.M., Burris, T.P., Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists. Nature, 2012. 485(7396): p. 62-68. DOI: 10.1038/nature11030.
13. Trump, R.P., Bresciani, S., Cooper, A.W.J., Tellam, J.P., Wojno, J., Blaikley, J., Orband-Miller, L.A., Kashatus, J.A., Boudjelal, M., Dawson, H.C., Loudon, A., Ray, D., Grant, D., Farrow, S.N., Willson, T.M., Tomkinson, N.C.O., Optimized Chemical Probes for REV-ERBα. Journal of Medicinal Chemistry, 2013. 56(11): p. 4729-4737. DOI: 10.1021/jm400458q.
14. Wolff, S.E.C., Wang, X.-L., Jiao, H., Sun, J., Kalsbeek, A., Yi, C.-X., Gao, Y., The Effect of Rev-erbα Agonist SR9011 on the Immune Response and Cell Metabolism of Microglia. Frontiers in Immunology, 2020. 11: p. 2463.
15. Banerjee, S., Wang, Y., Solt, L.A., Griffett, K., Kazantzis, M., Amador, A., El-Gendy, B.M., Huitron-Resendiz, S., Roberts, A.J., Shin, Y., Kamenecka, T.M., Burris, T.P., Pharmacological targeting of the mammalian clock regulates sleep architecture and emotional behaviour. Nature Communications, 2014. 5(1): p. 5759. DOI: 10.1038/ncomms6759.
16. Paulin, R., Lampron, M.-C., Vitry, G., Grobs, Y., Boucherat, O., Provencher, S., Bonnet, S., Therapeutic Potential of the Nuclear Receptor Modulator SR9011 for Treatment of Pulmonary Hypertension, in D96. WHAT’S NEW IN PAH AND RV SIGNALING: LESSONS FROM THE BEST ABSTRACTS. 2020, American Thoracic Society. p. A7672-A7672.
17. Thevis, M., Schänzer, W., Emerging drugs affecting skeletal muscle function and mitochondrial biogenesis – Potential implications for sports drug testing programs. Rapid Communications in Mass Spectrometry, 2016. 30(5): p. 635-651. DOI: https://doi.org/10.1002/rcm.7470.
18. Thevis, M., Kuuranne, T., Geyer, H., Annual banned-substance review: Analytical approaches in human sports drug testing. Drug Testing and Analysis, 2018. 10(1): p. 9-27. DOI: 10.1002/dta.2336.
19. Dierickx, P., Emmett, M.J., Jiang, C., Uehara, K., Liu, M., Adlanmerini, M., Lazar, M.A., SR9009 has REV-ERB-independent effects on cell proliferation and metabolism. Proc Natl Acad Sci U S A, 2019. 116(25): p. 12147-12152. DOI: 10.1073/pnas.1904226116.
20. Woldt, E., Sebti, Y., Solt, L.A., Duhem, C., Lancel, S., Eeckhoute, J., Hesselink, M.K.C., Paquet, C., Delhaye, S., Shin, Y., Kamenecka, T.M., Schaart, G., Lefebvre, P., Nevière, R., Burris, T.P., Schrauwen, P., Staels, B., Duez, H., Rev-erb-α modulates skeletal muscle oxidative capacity by regulating mitochondrial biogenesis and autophagy. Nat Med, 2013. 19(8): p. 1039-1046. DOI: 10.1038/nm.3213.
21. Mazzarino, M., Rizzato, N., Stacchini, C., de la Torre, X., Botrè, F., A further insight into the metabolic profile of the nuclear receptor Rev-erb agonist, SR9009. Drug testing and analysis, 2018. 10(11-12): p. 1670-1681. DOI: 10.1002/dta.2538.
22. Agency, W.A.-D. The World Anti-Doping Code International Standard. Prohibited List. 2018; Available from: https://www.wada-ama.org/sites/default/files/prohibited_list_2018_en.pdf.
23. Amir, M., Chaudhari, S., Wang, R., Campbell, S., Mosure, S.A., Chopp, L.B., Lu, Q., Shang, J., Pelletier, O.B., He, Y., Doebelin, C., Cameron, M.D., Kojetin, D.J., Kamenecka, T.M., Solt, L.A., REV-ERBα Regulates TH17 Cell Development and Autoimmunity. Cell Reports, 2018. 25(13): p. 3733-3749.e3738. DOI: https://doi.org/10.1016/j.celrep.2018.11.101.
24. Zhang, T., Zhao, M., Lu, D., Wang, S., Yu, F., Guo, L., Wen, S., Wu, B., REV-ERBα Regulates CYP7A1 Through Repression of Liver Receptor Homolog-1. Drug Metab Dispos, 2018. 46(3): p. 248-258. DOI: 10.1124/dmd.117.078105.
25. De Mei, C., Ercolani, L., Parodi, C., Veronesi, M., Vecchio, C.L., Bottegoni, G., Torrente, E., Scarpelli, R., Marotta, R., Ruffili, R., Mattioli, M., Reggiani, A., Wade, M., Grimaldi, B., Dual inhibition of REV-ERBβ and autophagy as a novel pharmacological approach to induce cytotoxicity in cancer cells. Oncogene, 2015. 34(20): p. 2597-2608. DOI: 10.1038/onc.2014.203.
26. Pariollaud, M., Gibbs, J.E., Hopwood, T.W., Brown, S., Begley, N., Vonslow, R., Poolman, T., Guo, B., Saer, B., Jones, D.H., Tellam, J.P., Bresciani, S., Tomkinson, N.C.O., Wojno-Picon, J., Cooper, A.W.J., Daniels, D.A., Trump, R.P., Grant, D., Zuercher, W., Willson, T.M., MacDonald, A.S., Bolognese, B., Podolin, P.L., Sanchez, Y., Loudon, A.S.I., Ray, D.W., Circadian clock component REV-ERBα controls homeostatic regulation of pulmonary inflammation. J Clin Invest, 2018. 128(6): p. 2281-2296. DOI: 10.1172/JCI93910.
27. Hering, Y., Berthier, A., Duez, H., Lefebvre, P., Deprez, B., Gribbon, P., Wolf, M., Reinshagen, J., Halley, F., Hannemann, J., Böger, R., Staels, B., Gul, S., Development and implementation of a cell-based assay to discover agonists of the nuclear receptor REV-ERBα. J Biol Methods, 2018. 5(3): p. e94-e94. DOI: 10.14440/jbm.2018.244.