Фавипиравир – синтетический противовирусный препарат широкого спектра действия. В настоящее время фавипиравир и его дженерики (Авифавир, Арепливир, Коронавир) активно исследуются и находят применение для лечения коронавирусной инфекции COVID-19. В данном обзоре рассматриваются свойства, особенности, история и некоторые клинические испытания фавипиравира и лекарств на его основе.
Фавипиравир (Avigan, Favilavir, Favipiravir, T-705, 3-гидрокси-6-фторпиразин-2-карбоксамид; CAS 259793-96-9) является новым синтетическим препаратом с противовирусной активностью с широкого диапазоном действия. Отличительной особенностью является его эффективность при пероральном введении. Структура фавипиравира отображена ниже (Рис. 1).
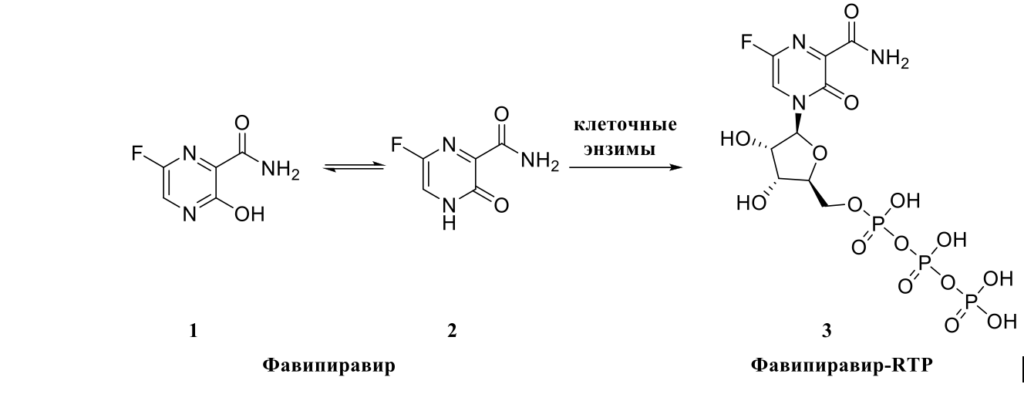
Рисунок 1 — Структурная формула фавипиравира (1) и образование фавипиравир-RTP (3)
Фавипиравир, общие сведения
Фавипиравир синтезирован в исследовательских лабораториях японской фармацевтической компании Toyama Chemical Co., которая включена в корпорацию Fujifilm. Toyama Chemical запатентовала фавипиравир в 2000 году в Японии [1], позже – и в других государствах, включая Россию [2]. В виде таблеток фавипиравир (торговое наименование Avigan) был одобрен в марте 2014 года для производства и продажи в Японии как противогриппозное лекарственное средство [3]. Фавипиравир обладает рядом побочных эффектов, из-за которых его рассматривали для применения лишь при угрозе вспышек неизвестных вирусных заболеваний или мутаций вирусов гриппа в случаях, когда прочие противовирусные препараты недостаточно эффективны или неэффективны полностью [3].
По причине глобальной пандемии инфекционного заболевания COVID-19, интерес к противовирусным препаратам резко увеличился, и, в частности, к фавипиравиру. Вирус не прекращает распространяться и стало причиной более 1 млн. смертей, а число заболевших уже превысило 36 млн. (см. обновляемую интерактивную карту [4]). Уже весной 2020 года появились публикации, в которых сообщали об эффективности фавипиравира по отношению к коронавирусу SARS-CoV-2, предварительные результаты были вполне обнадеживающими [5-7].
В России группой компаний «ХимРар» был разработан синтез дженерика фавипиравира, т. е., лекарственного средство с активным фармацевтическим ингредиентом, идентичному ранее запатентованному первоначальным разработчиком. Дженерик получил название «Авифавир» и показал хорошую эффективность в терапии пациентов c коронавирусной инфекцией. В мае 2020 года «Авифавир», таблетки по 200 мг, (ЛП-006225-290520) стал первым зарегистрированным в России противовирусным лекарством от COVID-19 [8, 9]. Регистрация была проведена согласно особой процедуре регистрации препаратов, предназначенных для использования в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Другой зарегистрированный препарат «Арепливир» (ЛП-006288) также содержит фавипиравир и производится АО «Биохимик». Третий фавипиравир-содержащий препарат российского производства – «Коронавир» (ЛП-006323), который изготавливает АО «Р-Фарм» [9]. Последние два также имеют дозировку 200 мг. В принципе, все три препарата можно считать идентичными по своей эффективности, незначительные отличия в веществах-наполнителях не влияют на активность фавипиравира. Лекарственная субстанция (ФС-002083) производится АО «Фармославль» [9]. Ранее фавипиравир был одобрен для лечения пациентов с COVID-19 в Китае (15 марта 2020 года) и Индии (20 июня 2020 года) [10].
Фавипиравир – производное пиразина с тремя заместителями (-OH, -F, -CONH2), Биологическая активность его молекулы обусловлена структурными особенностями – наличием вращающейся карбоксамидной группы -CONH2 и химическим сходством с гуанином и аденином, пуриновыми азотистыми основаниями. Препарат, по сути, является пролекарством, т. е., активным является не он сам, а продукты его метаболизма в живом организме. Из-за наличия гидроксильной группы, молекула обладает слабыми кислотными свойствами и способно таутомеризоваться (Рис. 1, 1→2). Кето-форма 2 под действием клеточных ферментов трансформируется в активное производное рибофуранозил-5′-трифосфата (фавипиравир-RTP, 3) [11]. Противовирусная активность фавипиравира снижается в присутствии пуриновых нуклеотидов АТФ (аденозинтрифосфат) и ГТФ (гуанозинтрифосфат), что указывает на способность вирусной РНК-зависимой РНК-полимеразы распознавать фавипиравир-RTP как псевдопуриновое основание [12, 13].
No post found!
Механизм действия фавипиравира обусловлен селективным ингибированием вирусной РНК-зависимой РНК-полимеразы. Ряд экспериментов показали, что препарат инициирует летальные мутации вируса при его репликации. Это приводит к образованию нежизнеспособных вирусных единиц, и, таким образом, вместо увеличения вирусная нагрузка резко снижается. В работе [14] было показано, что активация препарата целиком зависит от клеточного фермента HGPRT. Данный фермент в клетках млекопитающих проявляет свою активность против вирусов гриппа. Другие фосфорибозилтрансферазы, практически не участвуют во внутриклеточной активации фавипиравира. Кроме того, была определена кристаллическая структура комплекса фавипиравир-RMP с HGPRT человека, показавшая особенности взаимодействия аминокислотных остатков активного сайта фермента с молекулой препарата [14]. Фавипиравир-RTP представляет собой мощный субстрат полимеразы вируса гриппа A и встраивается ею в РНК в 19 и 30 раз эффективнее, чем природные ГТФ и АТФ, соответственно. Это приводит к летальным мутациям вируса, также связывание ингибирует РНК-полимеразу, однако до конца механизм действия еще не выяснен.
В ходе различных экспериментов было показано, что фавипиравир проявляет активность против следующих вирусов: желтой лихорадки (YFV), Зика (ZIKV), ящур, мышиный норовирус (MNV), вирус лихорадки Рифт-Валли, полиовирус, риновирус, вирус Конго-Крымской геморрагической лихорадки (CCHFV), вирусы Западного Нила (WNV), западного конского энцефалита (WEEV), Чикунгунья (CHIKV), вирус тромбоцитопении синдрома Bunyavirales (SFTSV), вирусы Ласса (LASV), Tacaribe, Guanarito, Heartland (HRTV), вирус Норфолк, Junin (JUNV), Pichinde (PICV), Machupo, вирус Син Номбре и вирус Анд, штаммы филовируса, вируса Эбола (EBOV), метапневмовирус человека (HMPV), ряд хантавирусов Старого и Нового Света, респираторно-синцитиальный вирус, Марбург, вирус болезни Борна (BDV), парагриппа человека, бешенства кори [13, 15, 16].
Отличительными чертами фавипиравира являются широкая активность по отношению к РНК-вирусам, высокая селективность и барьер к возникновению лекарственной устойчивости [13, 17]. При наличие фавипиравира в культуральной среде даже после 30 пересевов изменений в восприимчивости и появления резистентных штаммов вирусов гриппа типа А не наблюдалось, равно как и в проведенных клинических исследованиях [18].
В настоящее время в базу СlinicalTrials [19] внесено 37 клинических исследований на разных стадиях их проведения по использованию фавипиравира в терапии пациентов с коронавирусной инфекцией COVID-19, вызываемой вирусом SARS-CoV-2 [20]. Работы ведутся учеными по всему миру. К данному моменту завершено 7 испытаний фаз I–III, и одно остановлено. Далеко не все результаты успели выйти в печать, поэтому далее мы рассмотрим лишь опубликованные работы.
Клинические испытания фавипиравира и дженериков
Фавипиравир сам по себе и в комбинации с другими лекарственными средствами использовался в клинических испытаниях, направленных на лечение COVID-19. Эффективность была изучен против комбинации лопинавира/ритонавира. В нерандомизированном клиническом исследовании 35 пациентов лечились фавипиравиром в дозе 1600 мг дважды в день (первый день), 600 мг дважды в день (2–14-ый день), а 45 пациентов получали лопинавир/ритонавир в дозе 400 мг/100 мг дважды в день с 1 по 14 день [21]. Авторы обнаружили, что приём фавипиравира ассоциировался с более быстрым выздоровлением, снижением титра вируса и хорошими показателями улучшения в грудной клетки по визуализации рентгенограмм.
Многоцентровое открытое рандомизированное клиническое исследование показало превосходство фавипиравира (116 пациентов) по сравнению с умифеновиром (120 пациентов) у пациентов с COVID-19 в Ухане (Китай). Медики обнаружили, что у пациентов с умеренными протеканием COVID-19 (которые ранее не получали никаких противовирусных препаратов) фавипиравир показал более высокую эффективность с точки зрения скорости клинического выздоровления на 7-й день и снижения частоты эпизодов лихорадки и кашля. Частота клинического выздоровления на 7-й день составила 55,8% в группе умифеновира и 71,4% в группе фавипиравира [21].
Фавипиравир сравнивали с арбидолом в исследовании, в котором 240 пациентов случайным образом были разделены на две группы – 120 пациентов были отнесены к группе лечения фавипиравиром и 120 – арбидолом. [22]. Восстановление было быстрее в группе фавипиравира, однако не показало статистической разницы. Количество клинических выздоровлений к 7-му дню составило 71/116 в группе фавипиравира против 62/120 в контроле (61% против 52%).
Фавипиравир + осельтамивир также сравнивали с только осельтамивиром у тяжелобольных пациентов [22]. Был сделан вывод, что комбинированная терапия фавипиравиром и осельтамивиром должна быть официально оценена в рандомизированном контролируемом исследовании.
Минздрав России выдал ускоренное разрешение на продажу препарата «Авифавир» (фавипиравир) для лечения пациентов с COVID-19. На пилотном этапе клинических испытаний фазы II–III «Авифавир» обеспечил выведение вируса SARS-CoV-2 у 62,5% пациентов в течение 4 дней, был безопасным и хорошо переносимым [23]. В фазе II приняло участие 60 пациентов с подтвержденным диагнозом COVID-19. Пациенты были рандомизированы в соотношении 1:1:1 для приема либо «Авифавир» 1600 мг дважды в сутки в первый день с последующим приемом по 600 мг дважды в сутки в дни 2–14 (1600/600 мг), либо «Авифавир» 1800 мг дважды в сутки в первый день с последующим приемом 800 мг два раза в сутки во 2–14 дни (1800/800 мг) или гидроксихлорохин или хлорохин в соответствии с актуальными на тот момент рекомендациями по лечению COVID-19. В ходе исследования пациентам всех групп было разрешено использовать патогенетическое и симптоматическое лечение; пациентам в группах, получавших «Авифавир», не разрешалось применять другие противовирусные или противомалярийные препараты. Оба режима дозирования продемонстрировали сходный вирусологический ответ. На пятый день вирусный клиренс был достигнут у 25/40 (62,5%) пациентов, получавших «Авифавир», и у 6/20 (30,0%) пациентов, получавших гидроксихлорохин или хлорохин. К десятому дню вирусный клиренс был достигнут у 37/40 (92,5%) пациентов, получавших «Авифавир», и у 16/20 (80,0%) пациентов, получавших гидроксихлорохин или хлорохин. Таким образом, было достигнуто необходимое количество респондентов для доказательства концепции. Среднее время до нормализации температуры тела (<37 ⁰C) составило 2 дня в группах «Авифавира» и 4 дня в группе гидроксихлорохин/хлорохин. К 15 дню результаты КТ грудной клетки улучшились у 36/40 (90,0%) пациентов, получавших «Авифавир», и у 16/20 (80,0%) пациентов, получавших гидроксихлорохин/хлорохин. Неблагоприятные лекарственные реакции на «Авифавир» были зарегистрированы у 7/40 (17,5%) пациентов, и включали диарею, тошноту, рвоту, боль в груди и повышение уровня трансаминаз в печени. Побочные реакции привели к преждевременному прекращению приема исследуемого препарата у 2/40 (5,0%) пациентов. Два пациента, получавших «Авифавир» (1600/600 мг), были переведены в отделение интенсивной терапии, где получали искусственную вентиляцию легких и позже скончались. У обоих пациентов был повышенные риски тяжелого течения заболевания (сахарный диабет, артериальная гипертензия и ожирение в анамнезе). Доказанная эффективность препарата позволила зарегистрировать его для продажи и применения в РФ [8, 9].
Инструкция к препарату «Авифавир» описывает рекомендуемый режим дозирования: курс по 1600 мг два раза в сутки в первый день и далее по 600 мг два раза в сутки в 2–10 дни (для взрослых пациентов с массой <75 кг) или по 1800 мг два раза в сутки в первый день и далее по 800 мг два раза в сутки в 2–10 дни (если масса >75 кг) [18].
В ходе различных клинических испытаний фавипиравир продемонстрировал побочные эффекты, такие как кожная сыпь, повышенный уровень мочевой кислоты, повреждение печени, повреждение почек, подагра и даже обострение пневмонии. Также при применении наблюдались фавипиравира тератогенные эффекты, в связи с чем он не назначается беременным и рекомендуется избегать беременности 3 месяца после курса применения препарата. У мужчин фавипиравир, распределяясь в организме, попадает в сперму, и им следует избегать контакта с беременными, а также пользоваться соответствующими способами контрацепции.
Фавипиравир – это дорого?
Последнее время в СМИ часто встречаются полные возмущения статьи и комментарии касательно высоких цен на российские препараты – дженерики фавипиравира, причем даже после удешевления [24]. Такая реакция говорит о полном непонимании особенностей разработки синтеза препаратов-дженериков и переноса методов с лабораторного на промышленные масштабы, а также подтверждения биоэквивалентности дженерика и оригинального лекарственного средства. Особенно в крайне сжатые сроки и в условиях бушующей пандемии. Несмотря на кажущуюся простоту молекулы фавипиравира, синтез его далеко не прост из-за наличия атома фтора в шестом положении, введение которого требует применения жестких условия, опасных и агрессивных реагентов, что ведет к низким выходам конечного продукта, или же дорогостоящих катализаторов на основе благородных металлов (например, палладия) для введения аминогруппы. Впервые синтез фавипиравира описан в патенте 2000 года группой японских ученых под руководством д-ра Юсуки Фуруты (Yousuke Furuta) [1, 2, 25]. Синтетический путь состоял из семи стадий, а выход не превышал 10%. Позже было предложено несколько вариантов приготовления препарата, однако выход был улучшен незначительно – примерно до 20–30% [26-28]. Однако и новые синтетические методы получения фавипиравира демонстрируют проблемы синтеза данного препарата. Основными сложностями остаются многостадийность и ею обусловленный низкий выход конечного препарата. Таким образом, российскими химиками в чрезвычайно сжатые сроки была проделана колоссальная работа – «взлом» патентной информации, отработка сложного многостадийного синтеза на уровне лаборатории и перенос на масштаб фармацевтического производства. Очевидно, что в дальнейшем цена на отечественные препараты на основе фавипиравира будет снижаться по мере совершенствования и отлаживания технологии его синтеза.
1. WO 2000010569 A1, 2000.
2. RU 2224520 C2, 2002.
3. Avigan Tablet 200 mg. Report on the Deliberation Results. 2014 [Access Date: 2020-10-08]; Available from: https://www.pmda.go.jp/files/000210319.pdf.
4. Wuhan Coronavirus (2019-nCoV) Global Cases. JHU CSSE. 2020 [Access Date: 2020-10-08]; Available from: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6.
5. Cai, Q., Yang, M., Liu, D., Chen, J., Shu, D., Xia, J., Liao, X., Gu, Y., Cai, Q., Yang, Y., Shen, C., Li, X., Peng, L., Huang, D., Zhang, J., Zhang, S., Wang, F., Liu, J., Chen, L., Liu, L., Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study. Engineering, 2020. DOI: 10.1016/j.eng.2020.03.007.
6. Chemical, F.T. Fujifilm Toyama Chemical’s Favipiravir Shows some Promise in Japanese and Chinese COVID-19 Clinical Trials. 2020 [Access Date: 2020-03-30]; Available from: https://www.trialsitenews.com/fujifilm-toyama-chemicals-favipiravir-shows-some-promise-in-japanese-and-chinese-covid-19-clinical-trials/.
7. Chen, C., Huang, J., Yin, P., Zhang, Y., Cheng, Z., Wu, J., Chen, S., Zhang, Y., Chen, B., Lu, M., Luo, Y., Zhang, J., Wang, X., Favipiravir versus Arbidol for COVID-19: A Randomized Clinical Trial. medRxiv, 2020: p. 2020.2003.2017.20037432. DOI: 10.1101/2020.03.17.20037432.
8. Сурина, Е. Минздрав РФ одобрил первый российский препарат от коронавируса «Авифавир» производства СП РФПИ и ГК «ХимРар». 2020 [Access Date: 07.10.2020]; Available from: https://chemrar.ru/minzdrav-rf-odobril-pervyj-rossijskij-preparat-ot-koronavirusa-avifavir-proizvodstva-sp-rfpi-i-gk-ximrar/.
9. Государственный реестр лекарственных средств. [Access Date: 07.10.2020]; Available from: http://grls.rosminzdrav.ru/grls.aspx.
10. Lodangi, N., Thawani, V., Favipiravir in Covid-19. 2020.
11. El-Nahas, A., Hirao, K., A theoretical study on 2-hydroxypyrazine and 2,3-dihydroxypyrazine: tautomerism, intramolecular hydrogen bond, solvent effects. Journal of Molecular Structure: THEOCHEM, 1999. 459(1): p. 229—237. DOI: https://doi.org/10.1016/S0166-1280(98)00270-X.
12. Vanderlinden, E., Vrancken, B., Houdt, J.V., Rajwanshi, V.K., Gillemot, S., Andrei, G., Lemey, P., Naesens, L., Distinct Effects of T-705 (Favipiravir) and ribavirin on influenza virus replication and Viral RNA Synthesis. Antimicrobial Agents and Chemotherapy, 2016. 60(11): p. 6679 — 6691. DOI: 10.1128/AAC.01156-16.
13. Delang, L., Abdelnabi, R., Neyts, J., Favipiravir as a potential countermeasure against neglected and emerging RNA viruses. Antiviral Research, 2018. 153: p. 85 — 94. DOI: 10.1016/j.antiviral.2018.03.003.
14. Naesens, L., Guddat, L.W., Keough, D.T., Van Kuilenburg, A.B.P., Meijer, J., Vande Voorde, J., Balzarini, J., Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir). Molecular Pharmacology, 2013. 84(4): p. 615 — 629. DOI: 10.1124/mol.113.087247.
15. Furuta, Y., Takahashi, K., Fukuda, Y., Kuno, M., Kamiyama, T., Kozaki, K., Nomura, N., Egawa, H., Minami, S., Watanabe, Y., Narita, H., Shiraki, K., In Vitro and In Vivo Activities of Anti-Influenza Virus Compound T-705. Antimicrobial Agents and Chemotherapy, 2002. 46(4): p. 977. DOI: 10.1128/AAC.46.4.977-981.2002.
16. Furuta, Y., Komeno, T., Nakamura, T., Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proceedings of the Japan Academy Series B: Physical and Biological Sciences, 2017. 93(7): p. 449 — 463. DOI: 10.2183/pjab.93.027.
17. Furuta, Y., Takahashi, K., Shiraki, K., Sakamoto, K., Smee, D.F., Barnard, D.L., Gowen, B.B., Julander, J.G., Morrey, J.D., T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections. Antiviral Research, 2009. 82(3): p. 95 — 102. DOI: 10.1016/j.antiviral.2009.02.198.
18. Инструкция по медицинскому применению лекарственного препарата авифавир. Минздрав России. 2020.
19. СlinicalTrials. 2020; Available from: https://clinicaltrials.gov/ct2/results?cond=Covid19&term=Favipiravir.
20. Cosmeceuticals and Active Cosmetics. 3 ed. 2015, Boca Raton, U.S.: CRC Press Taylor & Francis Group. p. 437.
21. Seneviratne, S.L., Abeysuriya, V., De Mel, S., De Zoysa, I., Niloofa, R.J.I.J.o.P.S., Technologies, Favipiravir in COVID-19. 2020. 19(2): p. 143-145.
22. Organization, W.H. WHO R&D Blueprint. COVID-19 Informal consultation on the potential inclusion of Favipiravir in a clinical trial. 2020. Available from: https://www.who.int/docs/default-source/blue-print/informal-consultation-on-the-potential-inclusion-of-favipiravir-in-a-clinical-trial.pdf.
23. Ivashchenko, A.A., Dmitriev, K.A., Vostokova, N.V., Azarova, V.N., Blinow, A.A., Egorova, A.N., Gordeev, I.G., Ilin, A.P., Karapetian, R.N., Kravchenko, D.V., Lomakin, N.V., Merkulova, E.A., Papazova, N.A., Pavlikova, E.P., Savchuk, N.P., Simakina, E.N., Sitdekov, T.A., Smolyarchuk, E.A., Tikhomolova, E.G., Yakubova, E.V., Ivachtchenko, A.V., AVIFAVIR for Treatment of Patients with Moderate COVID-19: Interim Results of a Phase II/III Multicenter Randomized Clinical Trial. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, 2020: p. ciaa1176. DOI: 10.1093/cid/ciaa1176.
24. Невинная, И. РФПИ снизил цену на фавипиравир в аптеках на 30%. 2020; Available from: https://rg.ru/2020/09/24/rfpi-snizil-cenu-na-favipiravir-v-aptekah-na-30-procentov.html.
25. CZ 2001617 A3, 2001.
26. Liu, F.-L., Li, C.-Q., Xiang, H.-Y., Feng, S., A practical and step-economic route to Favipiravir. Chemical Papers, 2017. 71(11): p. 2153 — 2158. DOI: 10.1007/s11696-017-0208-6.
27. Wang, W., Liu, M., Xiao, X., Dai, Q., Synthesis of favipiravir. Journal of International Pharmaceutical Research, 2015. 42: p. 220–224. DOI: 10.13220/j.cnki.jipr.2015.02.018.
28. Guo, Q., Xu, M., Guo, S., Zhu, F., Xie, Y., Shen, J., The complete synthesis of favipiravir from 2-aminopyrazine. Chemical Papers, 2019. 73(5): p. 1043 — 1051. DOI: 10.1007/s11696-018-0654-9.