Ноотропные препараты направленны на улучшение когнитивных функций: памяти, внимания и концентрации. Рацетамы относятся к ноотропам и являются аналогами популярного лекарственного средства – пирацетама. Данный обзор посвящен рацетамам, с особым вниманием к двум представителям этого семейства – оксирацетаму и прамирацетаму.
Рацетамы – представители класса ноотропных препаратов
Использование терапевтических препаратов в медицинских и немедицинских целях в качестве усилителей познавательной способности распространилось значительно и, по-видимому, стало вполне приемлемыми для различных слоев населения. Принимая во внимание все более конкурентный характер современного общества, что также отражается на рабочих местах, разумно ожидать, что это явление со временем распространится еще больше; тем не менее, долгосрочные последствия становления таких препаратов в качестве основных «добавок» для повышения производительности пока неизвестны. «Когнитивные усилители» («cognitive enhancers» или «smart drugs»), используемые здоровыми людьми, широко известны как ноотропы: лекарства, добавки и другие вещества, которые могут улучшить когнитивные функции, укрепить память, творческий потенциал или даже мотивацию у здоровых людей, которые решают использовать их в попытке вывести свои способности «на новый уровень» [1]. Слово «ноотропный» было предложено в 1972 году румынским ученым, психологом и химиком, Корнелиу Джурджиа (Corneliu Giurgea), который в 1964 году впервые синтезировал пирацетам (ноотропил) [2, 3]. Данный термин для описания нового класса психотропов получен объединением греческих слов (греч. νόος – ум, τρόπος – направленный).
Общие определенные характеристики, необходимые, чтобы соединение было классифицировано как ноотропное, должны включать активацию механизмов мозга и, следовательно, компенсировать дефицит нервной активности без одновременной индукции подкорковой, лимбической или ретикулярной реакции. Более того, такое соединение должно улучшать память и обучение, будучи нетоксичными и безопасными [2, 4].
Фармацевтические вещества и соединения, известные как «усилители познавательной способности», как считается, могут повысить умственную работоспособность, способность сосредотачиваться и сохранять концентрацию. В более широком смысле, таким препаратам часто приписывают свойства, что они усиливают и развивают двигательные способности, аффективные навыки (т. е., способность справляться с тревогой, возникающей в результате выполнения определенных рабочих задач или вызывающих чувство доверия и принадлежности), и доступны для клинических и терапевтических целей. Кроме того, экономические условия, безусловно, играют роль в стимулировании конкуренции работников, в рамках которой некоторые могут чувствовать себя вынужденными рассматривать прием веществ для повышения своей производительности. Так, ключевым фактором, влияющим на использование ноотропов на рабочем месте, является повышение производительности, измеряемой объемом работы, производимой за рабочий час, то есть одним из основных факторов экономического роста и повышения уровня жизни [1].
Большинство соединений, описываемых как ноотропы, являются производными пирролидона, первым примером является пирацетам (Рис. 1) [5]. Пирацетам – относительно простое соединение, химически являющееся производным аналогом ГАМК. Его аналоги выделяют в группу т. н. рацетамов.
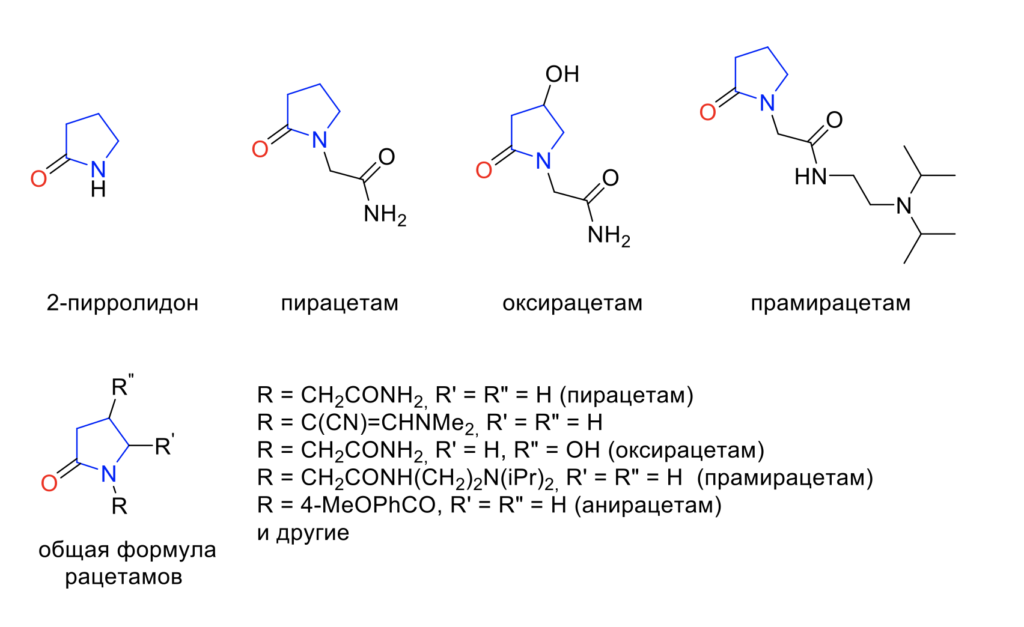
Рисунок 1 – Структуры рацетамов (цветом выделен родоначальный фрагмент)
Рацетамы – это класс лекарств, в который входят ноотропы, такие как пирацетам, анирацетам, оксирацетам, прамирацетам, фенилпирацетам и т. п. Все такие химические вещества имеют общее ядро пирролидона (Рис. 1) [1]. В частности, пирацетам является ноотропом, который используется с 1960-ых годов и до сих пор считается первым «умным лекарством» («smart drug»), популярным среди студентов из-за его наличия в некоторых пищевых добавках. Производное нейротрансмиттера γ-аминомасляной кислоты (ГАМК), пирацетам, обладает различными физиологическими эффектами, которые, как считается, возникают в результате улучшения текучести клеточных мембран. С точки зрения нейронов пирацетам действует как модулятор нейротрансмиссии в нескольких системах передачи (особенно холинергических и глутаматергических); кроме того, он может положительно влиять на нейропластичность благодаря своим нейропротекторным и противосудорожным свойствам. Со стороны сосудистой системы, пирацетам, по-видимому, снижает адгезию эритроцитов к эндотелию сосудов, препятствует вазоспазму и способствует микроциркуляции. Такие разнообразные физиологические эффекты привели к его использованию при широком круге клинических показаний. Сообщается, что он эффективен при лечении когнитивных расстройств и коркового миоклонуса, головокружения, дислексии, деменции и серповидно-клеточной анемии, хотя в некоторых исследованиях сообщалось о неблагоприятных исходах при лечении пациентов с психическим заболеванием в анамнезе [1].
Ранние клинические испытания на примере пирацетама показали эффективность рацетамов. Дети с дислексией, лечившиеся пирацетамом, читали лучше, но не наблюдалось никакого влияния на точность чтения или понимание прочитанного. Пирацетам повышал кратковременную слуховую память у людей с относительно плохой памятью. У взрослых мужчин с алкогольным психозом и повышенным церебральным кровотоком наблюдалось клиническое улучшение. Пиковые концентрации в сыворотке достигаются в течение одного часа, метаболизм происходит незначительно. Пирацетам потенцирует противосудорожные эффекты карбамазепина [5].
Были предложены взаимосвязи структурной активности для аналогов пирацетама, которые влияют на спонтанную двигательную активность, вызванную ретроградную амнезию и выживаемость в условиях гипоксии. Соединение с R = C(CN)=CHNMe2, R’ = R» = H в два раза активнее пирацетама в защите мышей от острой гипоксии. Оксирацетам (R = CH2CONH2, R’ = H, R» = OH) оказался более эффективным, чем пирацетам, в улучшении неврологических и соматических симптомов, связанных с хронической цереброваскулярной недостаточностью у пожилых пациентов, возможно, за счет ингибирования агрегации тромбоцитов. Активность была описана для серии аналогов прамирацетама. Анирацетам (R = 4-MeOPhCO, R’ = R» = H) улучшил точность у голубей и обезьян при взаимодействии с образцом с переменной задержкой и нейтрализовал индуцированное скополамином ухудшение памяти у обезьян. Была оценена активность тенилсетама в моделях познания на животных. Благоприятные эффекты, наблюдаемые с тенилсетамом могут отражать положительное воздействие на метаболические и холинергические функции. Химия и фармакология других производных изучены не достаточно глубоко. К настоящему времени уже известно более 15 различных представителей рацетамов, включая бициклические (димирацетам, ролзирацетам) и гетероциклические аналоги (колурацетам, тенилсетам), и их ряд постоянно расширяется [6, 7].
Отметим, что известны и не рацетамовые ноотропы. Пентоксифиллин, ингибитор ФДЭ, устраняет возрастной дефицит пространственной памяти. Пропентофиллин отменяет вызванную циклогексимидом амнезию у мышей и влияет на церебральный метаболизм у крыс, психомоторные функции, настроение и память человека. Пиритинол способствует удержанию усвоенной задачи у плохо обучающихся. Дефенон защищает от церебральной ишемической амнезии у крыс. Сульфоксазлин предохранял мышей от вызванной амнезии и гипоксии, не влияя на обучение и память. Буфломедил хорошо переносился пациентами с деменцией, и были отмечены некоторые улучшения когнитивных функций [5].
Оксирацетам
Оксирацетам (Oxiracetam, Hydroxypiracetam, Neuromet, Neuractiv, ISF 2522, 2-(4-гидрокси-2-оксо-1-пирролидинил)ацетамид CAS 62613-82-5; 68252-28-8, (R)-форма; 88929-35-5, (S)-форма; стереоизомеры могут быть выделены из рацемата [8]) относится рацетамам, проявляет ноотропные свойства, а также выступает в качестве легкого стимулятора (Рис. 1) [9, 10].
No post found!
Соединение известно с 1979 года. Ряд исследований подтверждают, что данный препарат безопасен даже при применении высоких доз на протяжении длительных периодов введения [11].
Механизм действия, как и для прочих рацетамов, не установлен однозначно, но известно, что оксирацетам является лигандом мускариновых рецепторов; его полумаксимальная ингибирующая концентрация (IC50) >1 мM [12]. Возможно, именно взаимодействия с рецепторами мускарина и обуславливает стимулирующие эффекты оксирацетама. Оксирацетам индуцирует высвобождение глутамата и стимулирует захват холина в изолированных срезах гиппокампа. Также, согласно результатам экспериментов на грызунах in vivo, он способствует ослаблению лекарственной амнезии, вызванной скополамином или мекамиламином (в дозе 50 и 100 мг/кг, внутрибрюшинно); отмене лекарственной амнезии после введения никотина, гемихолиния-3 или диазепама (10–300 мг/кг, внутрибрюшинно или подкожно); сокращению времени восстановления или улучшению работоспособности после гипоксии (100 мг/кг, внутривенно) [12]. Мыши после применения оксирацетама (ежедневно по 50 мг/кг внутрибрюшинно, 9 дней) демонстрировали значительное улучшение пространственного обучения против контрольной группы, что связывают с увеличением активности мембраносвязанной протеинкиназы С гиппокампа [13].
Оксирацетам исследовали на предмет потенциального использования при различных формах деменции, и, как сообщается, он хорошо переносится и не имеет побочных эффектов. Применение оксирацетама у пациентов, страдающих болезнью Альцгеймера (800 мг перорально дважды в день в течение 3 месяцев), эпилепсией (800 мг перорально трижды в день) или длительным воздействием органических растворителей (1200 мг перорально дважды в день в течение 3 месяцев), не увенчалось убедительным успехом [12]. С другой стороны, во многих исследованиях сообщается о положительном влиянии на логику, внимание, концентрацию, память и пространственную ориентацию после хронического приема оксирацетама (800–2400 мг перорально один или два раза в день в течение 1–6 месяцев) при деменции от легкой до умеренной степени у пожилых пациентов, пациентов, страдающих экзогенным постконтузионным синдромом и другими видами деменции или синдромами органического поражения головного мозга. Оксирацетам оказался более эффективным, чем прототипный ноотроп пирацетам, в исследовании, задействовавшем 289 пациентов [14]. Через 12 недель приема по 800 мг оксирацетама перорально дважды в день значения по шкале оценки деменции снизилось с 10,7 до 9,0 баллов, тогда как в группе плацебо изменений не наблюдалось. Также у принимавших препарат улучшилась пространственная ориентация, логические способности, концентрация и внимание.
Токсичность оксирацетама крайне низка – LD50>10 г/кг перорально (мыши, крысы и собаки) и > 500 мг/кг внутривенно (собаки). Благодаря высокой растворимости в воде (95,7% в водной фазе в системе н-октанол/вода) он легко поглощается из желудочно-кишечного тракта и имеет биодоступность 68–-82% [12]. Максимальные концентрации (Сmax) в сыворотке достигаются через 1–3 часа после однократного введения 800 или 2000 мг перорально, Сmax составляет 19–31 мкг/мл, соответственно.
Выведение оксирацетама осуществляется в основном почками, причем около 84% экскретируется с мочой в неизмененном виде. Период полувыведения препарата у человека составляет ~8 часов, однако при почечной недостаточности он достигает 10–68 часов. Проникновение сквозь гематоэнцефалический барьер ограничено, и концентрация в мозге составляет лишь 5,3% от концентрации в крови (через 1 час после введения 2000 мг внутривенно, однократно) [12]. Скорость клиренса изменяется в диапазоне 9–95 мл/мин, а стационарные концентрации находятся в широком интервале 60–530 мкМ во время курса по 800 мг дважды в день. Пути метаболизма оксирацетама аналогичны таковым для пирацетама и прочих рацетамов.
Никакого влияния на двигательную активность не наблюдалось после ведения оксирацетама (25–50 мг/кг внутрибрюшинно, мыши). Пренатальная обработка мышей оксирацетамом делает их более активно взаимодействующими с окружающей средой, и они лучше справляются с тестом в лабиринте, что предполагает усиление когнитивного развития после пренатального введения перпарата. Влияния на вес, сенсомоторные рефлексы и моторику не наблюдалось.
Важно отметить, что ранее все клинические исследования проводились с использованием рацемического оксирацетама. Изучение отдельных чистых оптических изомеров находится еще на начальных стадиях, однако уже известно, что (S)-оксирацетам (S-ORT) является основным активным компонентом рацемической смеси. Так, S-ORT защищает от ишемического инсульта, снижая дисфункцию гематоэнцефалического барьера у крыс [15]. Недавно, в 2020 году, были опубликованы результаты исследования фазы I по оценке профиля безопасности и фармакокинетики S-ORT на здоровых добровольцах по 10 человек в группе (2013L02096) [16]. В части 1 испытуемым внутривенно вводили однократную возрастающую дозу (2,0–8,0 г) препарата. В части 2 субъектов лечили по кросс-схеме с двумя последовательностями и двумя периодами. В части 3 участникам внутривенно вводили 4,0 г S-ORT один раз в день в течение 7 дней. Только у одного субъекта наблюдались легкие побочные эффекты. В пределах 2,0–8,0 г для разовой дозы Cmax возрастает с увеличением дозировки. Уровень экскреции с мочой препарата-прототипа составлял примерно 60%. Последовательное введение препарата не вызывало значительного накопления S-ORT. Кривые зависимости концентрации лекарственного средства в плазме от времени для S-ORT и (R)-оксирацетама (R-ORT) оказались почти идентичными. Таким образом, безопасность, переносимость и фармакокинетика S-ORT у здоровых добровольцев оказались приемлемыми. Очевидно, что эффективность оптически чистого препарата еще предстоит исследовать.
Прамирацетам
Прамирацетам (Pramiracetam, Pramistar, Amacetam, Vinpotropil, N-[2-(диизопропиламино)этил]-2-(2-оксо-1-пирролидинил)ацетамид, CAS 68497-62-1 ) является также близкородственным пирацетаму представителем ряда рацетамов и, будучи ноотропным агентом, проявляет некоторое стимулирующее действие на центральную нервную систему (Рис. 1).
No post found!
Прамирацетам был разработан исследователями компании Parke, Davis & Co. в 1978 году [12]. Под разными торговыми марками прамирацетам продается как средство для снижения дефицита памяти и внимания у пожилых пациентов с сосудистой и нейродегенеративной деменцией в странах EC [17]. В США препарат не одобрен к применению [18].
Прамирацетам увеличивает скорость захвата натрий-зависимого высокоаффинного холина в синаптосомах гиппокампа крысы in vitro, что позволяет предположить, что его влияние на когнитивные функции может происходить за счет ускорения холинергического нейронального импульсного потока в перегородочно-гиппокампальной области [9]. Обычная дозировка составляет 10–20 мг/кг/день (1,2 г/день), биодоступность ~100% и период полувыведения 2–8 часов [9].
Всасывание прамирацетама при пероральном приеме умеренно быстрое, пиковые концентрации в плазме (2,7–9,0 пг/мл), соответствующие общей концентрации 10,0–33,4 мM (связанной и свободной) достигаются через 2–3 часа после приема здоровыми добровольцами дозы 400–1600 мг перорально [12]. Средний период полувыведения, общий клиренс (4,45–4,85 мл/кг/мин), средний почечный клиренс (1,8–3,0 мл/кг/мин) и средний кажущийся объем распределения (1,8–2,9 л/кг) не зависят от дозы. Предполагают, что метаболизм при первом прохождении будет незначительным при условии, что лекарство не метаболизируется в кишечнике.
Прамирацетам более эффективен и поэтому используется в более низких дозах, чем пирацетам. Единственное испытание, проведенное в США, с участием четырех молодых людей (24–37 лет), у которых были проблемы с когнитивными функциями после травмы головы и гипоксии [19]. Применение прамирацетама по 400 мг перорально трижды в день двумя трехнедельными курсами значительно улучшило некоторые виды активности памяти, особенно отсроченное воспоминание (30–50% против плацебо) в течение 18 месяцев терапии и 1 месяца наблюдения.
Позже итальянские исследователи продемонстрировали снижение амнестических эффектов, вызванных скополамином, на 12 здоровых добровольцев, получавших прамирацетам по 600 мг два раза в день или плацебо в течение 10 дней подряд; два из пяти когнитивных параметров (включая тесты на немедленное и отсроченное вербальное воспоминание) были примерно на 50% лучше, чем в группе плацебо, при тестировании через 1 и 3 часа после инъекции скополамина [20]. В Украине были проведены два небольших исследования: одно на пациентах с цереброваскулярными заболеваниями [21] и еще одно – у пациентов с сотрясением мозга [22]. В первом испытании утверждается, что зрительная и вербальная память умеренно улучшилась у молодых пациентов с хроническими цереброваскулярными и постинсультными когнитивными симптомами, и в меньшей степени – у пожилых [21]. Данные второго исследования на 65 пациентах (16–60 лет), принимавших 600 мг прамирацетама дважды в день 1 месяц показывают, что прамирацетам более эффективен, чем пирацетам, в восстановлении потери или дезориентации памяти у пациентов с легкими черепно-мозговыми травмами; эффективность составляла 60–86% [22].
В плане терапии нейродегенеративных заболеваний, прамирацетам не показал эффективности. Эксперимент на мышах не выявил каких-либо демиелинизирующих изменений даже при дозе 600 мг/кг (хотя и подтвердилась безопасность высоких доз) [17].
Заключение
В настоящее время механизмы действия и эффективность препаратов семейства рацетамов все еще остается предметом исследований. Однако это не мешает людям активно пользоваться ноотропами как «допингом для мозга». Так, в Германии потребление пирацетама достигло максимального среди всех ноотропов и составило около 148 тонн в год (1,8 г на душу населения) в 2005 году [23]. Некоторые ноотропные препараты внесены в Запрещенный список Всемирного Антидопингового Кодекса (например, 4-фенилпирацетам [24]). Применение ноотропов, как относительно простой путь к повышению производительности, влечет за собой серьезные медицинские и этические проблемы. С одной стороны, доклинические и предварительные клинические исследования новых активаторов познавательной способности часто обнадеживают, но хорошо спланированные двойные слепые плацебо-контролируемые исследования пока не смогли продемонстрировать однозначных полезных эффектов таких лекарств.
No post found!
1. Zaami, S., Rinaldi, R., Bersani, G., Del Rio, A., Ciallella, C., Marinelli, E., Nootropics use in the workplace: psychiatric and ethical aftermath towards the new frontier of bioengineering. European review for medical and pharmacological sciences, 2020. 24(4): p. 2129-2139. DOI: 10.26355/eurrev_202002_20393.
2. Giurgea, C., The “nootropic” approach to the pharmacology of the integrative activity of the brain 1, 2. Conditional reflex: a Pavlovian journal of research & therapy, 1973. 8(2): p. 108-115. DOI: 10.1007/BF03000311.
3. Giurgea, C.E., Greindl, M.G., Preat, S., Nootropic drugs and aging. Acta psychiatrica Belgica, 1983. 83(4): p. 349-358.
4. Giurgea, C.E., The nootropic concept and its prospective implications. Drug Development Research, 1982. 2(5): p. 441-446. DOI: 10.1002/ddr.430020505.
5. To Market, To Market-1985, in Annual Reports in Medicinal Chemistry, B.D. M., Editor. 1986, Elsevier. p. 333.
6. Elks, J., Ganellin, C.R., Dictionary of Drugs: Chemical Data, Structures and Bibliographies, ed. J. Elks, Ganellin, C.R. 1990, Boston, MA: Springer US. p. 474.
7. Zhmurenko, L.A., Litvinova, S.A., Mokrov, G.V., Kovalev, I.G., Voronina, T.A., Nerobkova, L.N., Gudasheva, T.A., Synthesis of 4-Phenylpyrrolidone Derivatives with Anticonvulsant and Nootropic Activity. Pharmaceutical Chemistry Journal, 2019. 53(5): p. 429-435. DOI: 10.1007/s11094-019-02015-x.
8. Shemchuk, O., Song, L., Tumanov, N., Wouters, J., Braga, D., Grepioni, F., Leyssens, T., Chiral Resolution of RS-Oxiracetam upon Cocrystallization with Pharmaceutically Acceptable Inorganic Salts. Crystal Growth & Design, 2020. 20(4): p. 2602-2607. DOI: 10.1021/acs.cgd.9b01725.
9. Malykh, A.G., Sadaie, M.R., Piracetam and Piracetam-Like Drugs. Drugs, 2010. 70(3): p. 287-312. DOI: 10.2165/11319230-000000000-00000.
10. Valzelli, L., Baiguerra, G., Giraud, O., Difference in learning and retention by Albino Swiss mice. Part III. Effect of some brain stimulants. Methods and findings in experimental and clinical pharmacology, 1986. 8(6): p. 337-341.
11. Parnetti, L., Mecocci, P., Petrini, A., Longo, A., Buccolieri, A., Senin, U., Neuropsychological Results of Long-Term Therapy with Oxiracetam in Patients with Dementia of Alzheimer Type and Multi-Infarct Dementia in Comparison with a Control Group. Neuropsychobiology, 1989. 22(2): p. 97-100. DOI: 10.1159/000118599.
12. Gouliaev, A.H., Senning, A., Piracetam and other structurally related nootropics. Brain Research Reviews, 1994. 19(2): p. 180-222. DOI: https://doi.org/10.1016/0165-0173(94)90011-6.
13. Fordyce, D.E., Clark, V.J., Paylor, R., Wehner, J.M., Enhancement of hippocampally-mediated learning and protein kinase C activity by oxiracetam in learning-impaired DBA/2 mice. Brain Research, 1995. 672(1): p. 170-176. DOI: https://doi.org/10.1016/0006-8993(94)01389-Y.
14. Maina, G., Fiori, L., Torta, R., Fagiani, M.B., Ravizza, L., Bonavita, E., Ghiazza, B., Teruzzi, F., Zagnoni, P.G., Ferrario, E., Oxiracetam in the treatment of primary degenerative and multi-infarct dementia: a double-blind, placebo-controlled study. Neuropsychobiology, 1989. 21(3): p. 141-145. DOI: 10.1159/000118567.
15. Huang, L., Shang, E., Fan, W., Li, X., Li, B., He, S., Fu, Y., Zhang, Y., Li, Y., Fang, W., S-oxiracetam protect against ischemic stroke via alleviating blood brain barrier dysfunction in rats. European Journal of Pharmaceutical Sciences, 2017. 109: p. 40-47. DOI: https://doi.org/10.1016/j.ejps.2017.07.029.
16. Liang, D., Xie, H., Sun, H., Jia, Y., Dai, M., Shao, J., Jiang, Y., Li, X., Yang, B., Shen, J., A study investigating safety and pharmacokinetics of S-oxiracetam injection in healthy volunteers. Authorea Preprints, 2020.
17. Angeles, A., Ples, M., Vitor Ii, R.J., The effect of pramiracetam in the myelination of the hippocampus in the BALB/c mouse (Mus musculus). National Journal of Physiology, Pharmacy and Pharmacology, 2018: p. 1. DOI: 10.5455/njppp.2017.7.0832609112017.
18. Peak Nootropics LLC aka Advanced Nootropics. MARCS-CMS 557887. 2019; Available from: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/peak-nootropics-llc-aka-advanced-nootropics-557887-02052019.
19. McLean, A., Cardenas, D.D., Burgess, D., Gamzu, E., Placebo-controlled study of pramiracetam in young males with memory and cognitive problems resulting from head injury and anoxia. Brain Injury, 1991. 5(4): p. 375-380. DOI: 10.3109/02699059109008110.
20. Mauri, M., Sinforiani, E., Reverberi, F., Merlo, P., Bono, G., Pramiracetam effects on scopolamine-induced amnesia in healthy volunteers. Archives of Gerontology and Geriatrics, 1994. 18(2): p. 133-139. DOI: https://doi.org/10.1016/0167-4943(94)00542-7.
21. Dziak, L.A., Golik, V.A., Miziakina, E.V., [Experience in the application of pramistar, a new nootropic preparation, in the treatment of memory disorders in patients with cerebrovascular pathology]. Lik Sprava, 2003(8): p. 67-72.
22. Tkachev, A.V., [Application of nootropic agents in complex treatment of patients with concussion of the brain]. Lik Sprava, 2007(5-6): p. 82-85.
23. Wilms, W., Woźniak-Karczewska, M., Corvini, P.F.X., Chrzanowski, Ł., Nootropic drugs: Methylphenidate, modafinil and piracetam – Population use trends, occurrence in the environment, ecotoxicity and removal methods – A review. Chemosphere, 2019. 233: p. 771-785. DOI: https://doi.org/10.1016/j.chemosphere.2019.06.016.
24. Международный Стандарт: Кодекс, Всемирный Антидопинговый. Приложение 1. Запрещенный список. 2020; Available from: https://rusada.ru/upload/iblock/06d/%D0%97%D0%B0%D0%BF%D1%80%D0%B5%D1%89%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9%20%D1%81%D0%BF%D0%B8%D1%81%D0%BE%D0%BA%202020.pdf.