Глобальная пандемия коронавирусного заболевания COVID-19, причиной которой является вирус SARS-CoV-2, продолжается; количество пострадавших от него растет [1, 2]. Универсального лекарственного средства до сих пор не найдено, его поиск все еще остается актуальной задачей для ученых и медиков во всем мире. Один из возможных путей к нахождению эффективного препарата – это проверка уже известных противовирусных агентов на активность по отношению к SARS-CoV-2. В данном обзоре кратко рассмотрен ряд таких потенциально полезных препаратов.
Ремдезивир (Remdesivir; Veklury; GS-5734; CAS 1809249-37-3)
Ритонавир (Ritonavir, RTV, Norvir; CAS 155213-67-5)
Хлорохин (Chloroquine, CQ; CAS 54-05-7)
Гидроксихлорохин (Hydroxychloroquine, HCQ, Plaquenil; CAS 118-42-3)
Фавипиравир (Favipiravir, Avigan, Favilavir, T-705, CAS 259793-96-9)
Сивелестат (Sivelestat, ONO-5046, Elaspol; CAS 127373-66-4)
Моксифлоксацин (Moxifloxacin, Avelox, Vigamox, Esthipia, Moxiflox; CAS 151096-09-2)
Камостат (Camostat, Foipan; CAS 59721-28-7)
Лопинавир (Lopinavir, ABT-378; CAS 192725-17-0)
Ремдезивир
Ремдезивир (Remdesivir; Veklury; GS-5734; CAS 1809249-37-3)
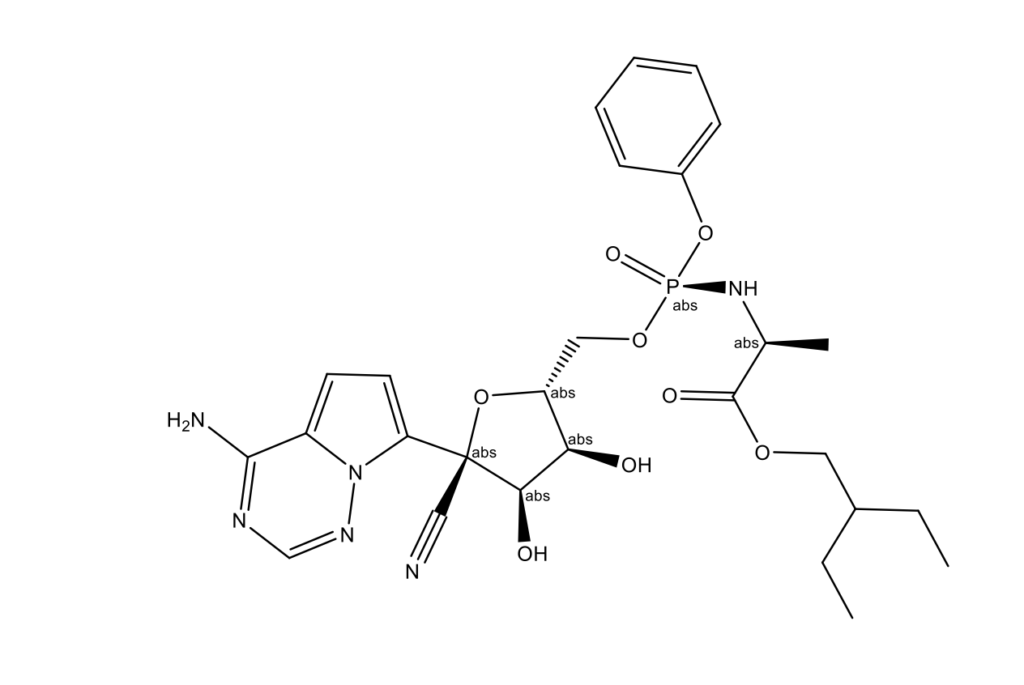
Ремдесивир разработан компанией Gilead Sciences и разрешен для применения в ~50 странах [7], включая США [8].
В настоящее время есть свидетельства того, что ремдесивир может быть эффективным в борьбе с инфекцией COVID-19. Ремдезивир представляет собой пролекарство, монофосфорамидат, превращающееся в организме в активный нуклеозидтрифосфат, ремдезивир-трифосфат-TP. Ремдесивир-TP, структурно аналогичный аденозинтрифосфату (АТФ), конкурирует с последним за включение в формирующиеся цепи РНК вируса. После включения в вирусную РНК лекарство, по-видимому, ускользает от проверки вирусной экзорибонуклеазой, ферментом, который, как считается, удаляет мутантные аналоги нуклеотидов, а также либо останавливают рост цепи РНК, будучи инициированным после добавления нескольких нуклеотидов, либо задерживает обрыв цепи во время репликации вирусной РНК. Недавно предположили, что ремдесивир может быть эффективным по отношению к коронавирусу. Сообщается о сокращении времени восстановления у пациентов с COVID-19 с 15 дней (плацебо) до 11 дней при его применении [3]. Хотя у коронавирусов присутствует процесс коррекции, который способен обнаруживать и удалять аналоги нуклеозидов и делать вирус устойчивыми ко многим антивирусным препаратам, ремдесивир, похоже, опережает корректирующую деятельность вируса, тем самым сохраняя свою противовирусную активность. Ремдесивир-TP – слабый ингибитор ДНК- и РНК-полимераз млекопитающих с низким потенциалом митохондриальной токсичности.
Введение ремдесивира в течение короткого временного интервала обеспечивает такое же исходное воздействие, как и та же доза, вводимая в течение более длительного периода (та же доза 75 мг внутривенно за 30 минут против 120 минут), клинически 75 мг внутривенно более 30 мин – более эффективный метод дозирования для максимального увеличения внутриклеточных уровней активного метаболита. Для метаболита наблюдался продолжительный внутриклеточный период полувыведения – более 35 часов, что позволяет использовать прием ремдесивира один раз в сутки. Соответствующие фармакокинетические параметры, полученные при инфузиях 75 мг за 30 мин для ремдезивира и его активного трифосфатного метаболита: T½=1,0 и 48,8 часов, соответственно, с коэффициентом накопления 3,5 для метаболита. Эти значения очень близки к значениям, полученным для инфузий 75 мг за 120 мин (данные согласно плану исследований и разработок ВОЗ для лечения геморрагической лихорадки Эбола [4]).
В первом клиническом исследовании фазы III (NCT04280705; ACTT-1), участвовало 1062 пациента с подтвержденным диагнозом COVID‑19. 541 из них получали ремдесивир и 521 – плацебо, параллельно с обычным лечением. Ремдесивир вводили внутривенно, 200 мг в первый день, после – по 100 мг ежедневно общим курсом до 10 дней. У получавших ремдесивир, время выздоровления было 10 дней против 15 в контроле. Обнаружено, что применение ремдесивира с большей вероятностью вело к клиническому улучшению. Смертность в группе, получавшей ремдесивир, составила 6,7% против 11,9% в контроле через 15 дней и 11,4% против 15,2% через 29 дней. Нежелательные эффекты наблюдались у 24,6% в группе ремдесивира против 31,6% в контрольной.
В исследовании NCT04292730 изучали различные схемы введения препарата [5]. Участники (596 человек) продолжали получать стандартную терапию вместе с ремдесивиром 200 мг в первый день, а затем по 100 мг на 2-ой, 3-ий, 4-ый и 5-ый дни. Другая схема – 200 мг в 1-й день, а затем – по 100 мг в дни 2–10. На 11 день пациенты в группе с 5-дневной схемой показали лучшее распределение клинического статуса, чем пациенты, получавшие стандартную помощь (отношение шансов 1,65). Распределение клинического статуса на 11-й день между группами 10-дневного курса и стандартной медицинской помощи не отличалось достоверно. К 28 дню умерло 9 пациентов: 2 (1%) в группе 5-дневной схемы, 3 (2%) в группе 10-дневной и 4 (2%) в группе стандартного лечения. Аналогичный эксперимент проведен в исследовании NCT04292899, но авторы пришли к выводу, что существенной разницы между 5-дневным курсом и 10-дневным курсом ремдесивира нет [6].
В базе СlinicalTrials в настоящее время содержится 66 испытаний ремдесивира при COVID-19, в основном находящихся на начальных этапах [5].
Ритонавир
Ритонавир (Ritonavir, RTV, Norvir; CAS 155213-67-5)
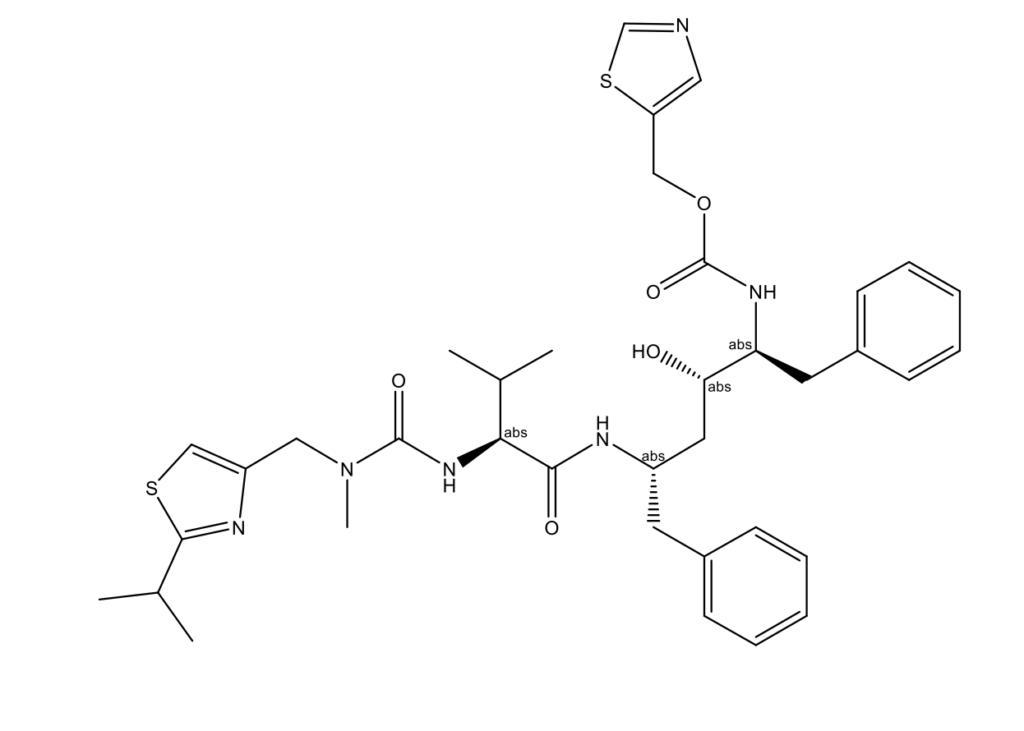
Ритонавир разработан компанией AbbVie, Inc [7]. В предварительных исследованиях изучались возможные комбинации, включающие ингибиторы протеазы ритонавир+лопинавир, которые применяются во всем мире. Основные ингибиторы протеаз контролируют активность репликационного комплекса SARS-CoV-2. Одной из наиболее охарактеризованных лекарственных мишеней в SARS-CoV-2 является основная протеаза Mpro, химотрипсиноподобная цистеиновая протеаза, также называемая 3CLpro. Наряду с другой протеазой, папаин-подобной цистеиновой протеазой (PLp), Mpro необходим для процессинга полипротеинов, транслируемых с вирусной РНК. Последовательности белка Mpro на 96% идентичны между SARS-CoV и SARS-CoV-2, и пространственная структура кармана связывания лопинавира/ритонавира в Mpro также сохраняется между двумя вирусами [8]. Mpro – это сайт для мощных ингибиторов широкого спектра действия COVID-19 Mpro; нелфинавир, лопинавир и пептидомиметические α-кетоамиды [9]. Однако протеазы SARS-CoV-2, включая Mpro, не имеют С2-симметричного кармана, который является мишенью ингибиторов протеазы ВИЧ.
Сообщалось о благоприятном клиническом ответе после введения умифеновира к сочетанию лопинавир/ритонавир [10]. Также добавление барицитиниба способно понизить вирусную нагрузку и аберрантную воспалительную реакцию хозяина.
В исследовании [11] 199 пациентов с лабораторно подтвержденной инфекцией SARS-CoV-2 были рандомизированы на две группы; 99 из них получали терапию лопинавир/ритонавир (400 мг и 100 мг, соответственно, два раза в день в течение 14 дней) и 100 – стандартное лечение. Применение комбинации лопинавир/ритонавир/ не было связано с разницей по времени до клинического улучшения по сравнению со стандартным лечением. В модифицированном анализе лопинавир/ритонавир время до клинического улучшения было на 1 день короче, чем при стандартной терапии. Нежелательные явления со стороны желудочно-кишечного тракта чаще встречались в группе лопинавир/ритонавир, но серьезные нежелательные явления чаще наблюдались при стандартной терапии. Лечение лопинавиром/ритонавиром было прекращено досрочно у 13 пациентов (13,8%) из-за побочных эффектов.
В настоящее время 94 испытания внесены в базу ClinicalTrials по применению различных комбинаций с ритонавиром, но результаты пока не опубликованы [12].
Хлорохин
Хлорохин (Chloroquine, CQ; CAS 54-05-7)
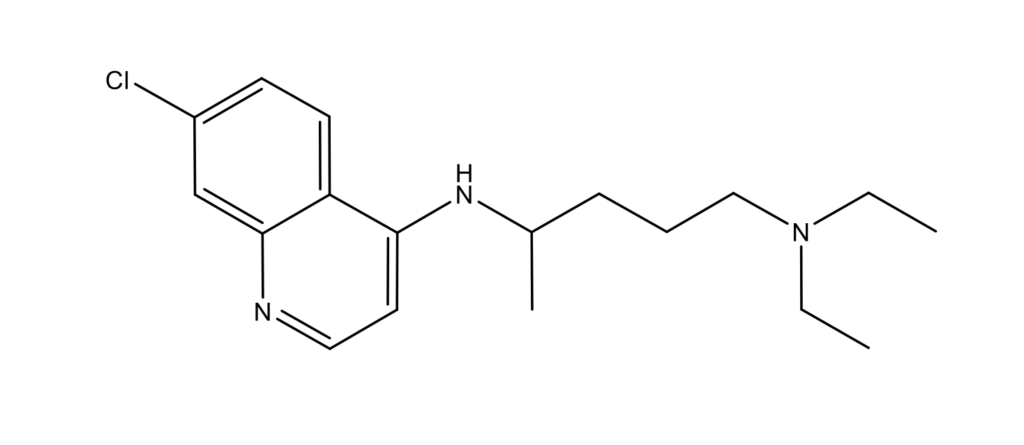
Хлорохин, производное 4-аминохинолина, известен с 1934 года и применяется для профилактики и лечения малярии [13]. Кроме того, CQ и гидроксихлорохин (HCQ) включены в протокол лечения других заболеваний, таких как ревматоидный артрит, красная волчанка и антифосфолипидный синдром. Недавно оба препарата вошли в парадигму лечения COVID-19. Обоснованием их использования для лечения COVID-19 является комплексный механизм действия. Лекарства эффективны против вируса, вызывают иммунную модуляцию и помогают подавить обострение пневмонии. CQ не влияет на уровень экспрессии ACE2 на поверхности клеток, но препятствует гликозилированию клеточных рецепторов SARS-CoV и ACE2. ACE2, который не находится в гликозилированном состоянии, может менее эффективно взаимодействовать с гликопротеином шипа SARS-CoV-2, дополнительно подавляя проникновение вируса [14]. Соответственно, CQ/HCQ снижает эффективность взаимодействия ACE2-SARS-CoV, и поэтому CQ блокирует слияние вируса с клеткой и проникновение вируса в клетку.
CQ ингибирует GSK-3β и потенцирует индуцированное литием ингибирование GSK-3 β и α. Это может обосновать комбинацию трех ингибиторов GSK-3β: лития, гидроксихлорохина и цинка для обеспечения синергетического действия. Более того, сообщается, что CQ обладает иммуномодулирующими эффектами, которые включают снижение продукции и высвобождения фактора некроза опухоли-α (TNF-α) и интерлейкина (IL)-6. CQ также предотвращает дальнейшие вредоносные механизмы, которые могут привести к острому респираторному синдрому, такие как изменение плотных контактов, дальнейшее высвобождение провоспалительных цитокинов и повышение проницаемости микрососудов [15].
Повышенная кислотность является предпосылкой слияния вирусной оболочки с эндосомальной и лизосомной мембранами или для переваривания гликопротеина и высвобождения вирусной РНК. CQ — катионный слабо основной препарат. Он является «лизосомотропным», проникает в эндосомы и лизосомы и действует как протонный магнит, становится протонированным внутри лизосомы и остается захваченным внутри (захватывая ионы). Он захватывает и задерживает протоны внутри лизосомы, предотвращает повышенную кислотность, увеличивая pH с 4,5 до 7,4 и, таким образом, ухудшает кислотную среду эндосом и лизосом и, следовательно, нарушает слияние лизосомы и аутофагосомы, а также разрушающую функцию лизосомы [16]. Клетки, обработанные CQ или HCQ, имели значительно больше вирионов, локализованных в ранних эндосомах, и меньше – в эндолизосомах. CQ также втягивает воду в лизосомы за счет осмотического эффекта, который также приводит к вакуолизации.
CQ N-деалкилируется в основном CYP2C8 и CYP3A4 (в меньшей степени CYP1A1) до активного метаболита, сначала до N-дезэтилхлорохина (39%), а последний далее N-деалкилируется до N-бидэтилхлорохина. Последний в конечном итоге превращается в 4-амино-7-хлорхинолин. CQ на 60% связывается с белками плазмы, как с альбумином, так и с α1-кислым гликопротеином. Однако препарат имеет объем распределения от 200 до 800 л/кг при расчете на основе концентраций в плазме и 200 л/кг при оценке на основе данных цельной крови (концентрации в 5–10 раз выше). Большой объем распределения можно объяснить сильным связыванием CQ с пигментированными тканями (включая сетчатку), мононуклеарными клетками, мышцами. Следовательно, распределение, а не процессы выведения, определяют профиль концентрации в крови и длительный T½. CQ. Более того, CQ имеет общий плазменный клиренс 0,35–1 л/ч/кг, при этом 21–47% экскретируется в неизмененном виде. Концентрация CQ при внутривенном введении достигает 650–1300 мкг/л, тогда как при пероральном приеме CQ достигает 65–128 мкг/л с Tmax 0,5 ч.
Важные кинетические взаимодействия с CQ были зарегистрированы для d-пеницилламина и циметидина, но не были обнаружены для аспирина, ранитидина или имипрамина. CQ может вызвать потенциально смертельную гипотензию и аритмию, которые приводят к прекращению приема CQ/HCQ. И CQ, и HCQ блокируют KCNH2-кодируемый калиевый канал HERG/K v 11.1 и потенциально могут влиять на сердце. У людей из группы риска блокаторы HERG могут вызывать риск нарушения сердечного ритма, который увеличится при комбинации CQ или HCQ с лопинавиром/ритонавиром и азитромицином. Хинины, как правило, следует применять с особой осторожностью у пациентов с дефицитом G6PD и сахарным диабетом. Парентерально хлорохин следует вводить либо путем непрерывной внутривенной инфузии, либо путем частых внутримышечных или подкожных инъекций относительно небольших доз.
CQ представляет собой ионофор цинка, который обеспечивает проникновение ионов цинка в клетки и направляет цинк в лизосомы, тем самым вызывая апоптоз [17]. Можно предположить, что это свойство могло сделать добавление ионов Zn2+ к CQ/HCQ более эффективным при лечении COVID-19.
Однозначных результатов по эффективности нет, поэтому FDA отозвало разрешение на экстренное использование хлорохина и гидроксихлорохина при лечении COVID-19 [18]. В странах ЕС препарат разрешен исключительно для проведения клинических исследований [19]. В Корее медики рекомендовали принимать CQ по 500 мг перорально в день [20]. При этом, в настоящее время проводится 90 испытаний с хлорохином [12].
Гидроксихлорохин
Гидроксихлорохин (Hydroxychloroquine, HCQ, Plaquenil; CAS 118-42-3)
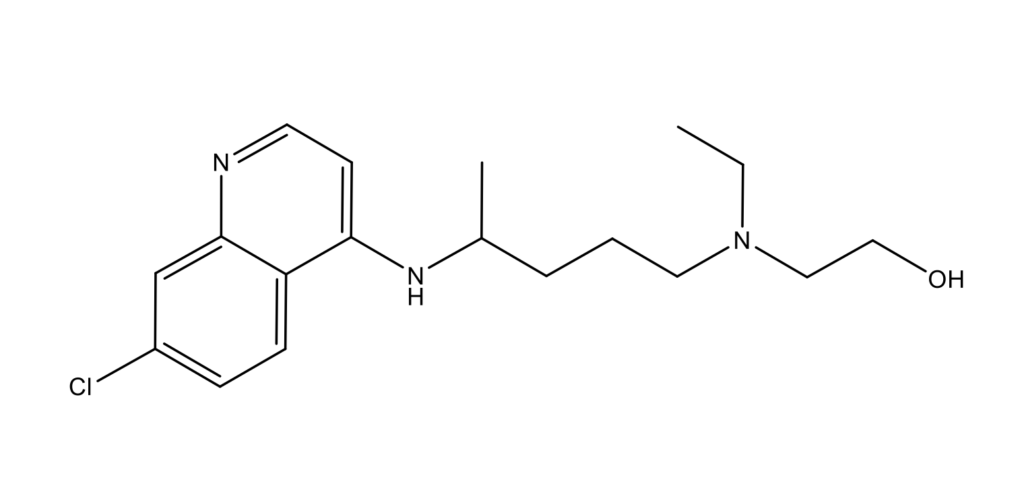
Гидроксихлорохин – известный противомалярийный препарат [21]. HCQ является аналогом CQ, в котором один из N-этильных заместителей CQ гидроксилирован. Активность HCQ эквивалентна или даже более мощна, чем CQ. HCQ предпочтительнее CQ, когда требуются высокие дозы из-за более низкого уровня глазной токсичности HCQ, чем CQ. HCQ, как и CQ, представляет собой хиральный препарат, вводимый в виде рацемата (в виде смеси 1:1 двух парных энантиомеров, (S)-(+) и (R)-(-)). (R)-(-)-CQ сильнее связывается с гликопротеином α1-кислоты, тогда как (S)-(+)-CQ больше связывается с альбумином. Следует отметить, что в то время, как (R)-(-) и (S)-(+) изомеры CQ имеют схожий профиль эффективности и токсичности, HCQ демонстрирует стереоселективный метаболизм. (R)-(-)-HCQ присутствует в крови в более высоких концентрациях, чем (S)-(+)-HCQ. Сообщалось, что (S)-(+)-HCQ представляет собой энантиомер, обладающий желаемой фармакологической активностью с меньшей токсичностью. (R)-(-)-Энантиомер HCQ накапливается в ткани глаза и вызывает усиление ретинопатии. Между энантиомерами (S)-(+)-HCQ и (R)-(-)-HCQ не происходит взаимного превращения. Клинические последствия использования препарата (S)-(+)-HCQ, практически не содержащего (R)-(-)-HCQ, считаются более благоприятными, поскольку ожидается, что активный ингредиент обеспечит более низкую ADR и возможность применения более высоких уровней доз и/или более длительных периодов приема. Использование HCQ для лечения COVID-19 все еще обсуждается. Применение подходящего изомера лекарственного средства в минимальной эффективной дозе и продолжительности, учитывая состояние сердца пациента, и добавление препарата могло повысить эффективность и свести к минимуму токсические эффекты, возникающие во время терапии. HCQ производит те же молекулярные эффекты, что и CQ, и, как CQ, репрессирует CD154, экспрессирующие Т-клетки, и препятствует связыванию SARS-CoV-2 с клетками-хозяевами [22]. Около 50% HCQ в плазме связывается с белками плазмы. HCQ метаболизируется в печени с образованием трех активных метаболитов: дезэтил-CQ (18%), дезэтил-HCQ (16%) и бисдезетил HCQ. HQ разделяет CQ большинство фармакокинетических параметров с некоторыми отличиями [23]: почечный клиренс 21% против 51%; объем распределения кровь/плазма 47,257 л/5,500 л против 65000 л/15,000 л; фракция выводится неметаболизированной 62% против 58%; T½ 45 ± 15 дней против 41 ± 11 дней для HCQ по сравнению с CQ, соответственно.
Известно взаимодействие лекарств с CQ и HCQ. Сообщалось о значительных лекарственных взаимодействиях с CQ и HCQ для дигоксина, противоэпилептических средств, антацидов, циклоспорина, амиодарона, азитромицина, моксифлоксацина, инсулина и противодиабетических средств, тамоксифена и празиквантела. Более того, комбинация азитромицина с HCQ часто клинически значимо удлиняет интервал QT. Этот эффект усиливается при повторении лечения с течением времени. Кроме того, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов отозвало разрешение на экстренное использование пероральных препаратов HCQ и CQ из-за проблем с эффективностью и дисбаланса вреда и польза. В Корее рекомендуют HCQ при COVID-19 в дозировке по 400 мг перорально в день [20].
В базе упомянуто 261 испытание гидроксихлорохина при COVID-19 [12].
Фавипиравир
Фавипиравир (Favipiravir, Avigan, Favilavir, T-705, CAS 259793-96-9)
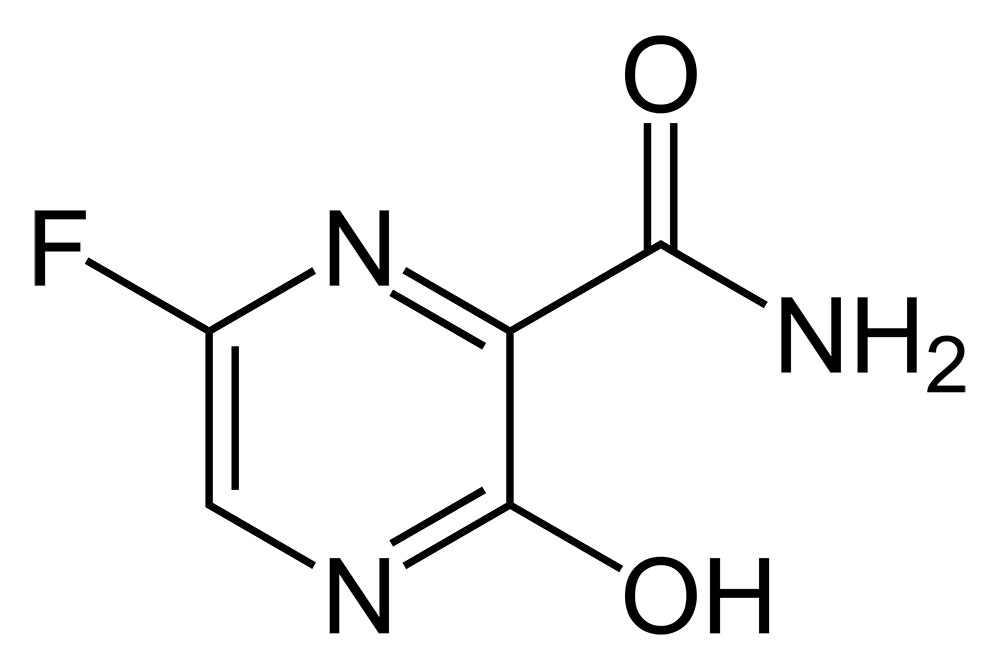
Фавипиравир, производное пиразинкарбоксамида, является противовирусным аналогом нуклеозида гуанидина широкого спектра действия. Он был одобрен для лечения гриппа человека. Фавипиравир – селективный ингибитор RdRp. Более того, фавипиравир ингибирует связывание белка оболочки и белка ORF7a с порфирином SARS-CoV-2. Также предполагается, что фавипиравир индуцирует летальные трансверсионные мутации РНК, которые приводят к нежизнеспособному вирусному фенотипу [24]. Фавипиравир также действует как мощный GTP-конкурентный ингибитор вирусной полимеразы.
Фавипиравир по фармакокинетическим параметрам: Cmax, 18,0 мкг/мл и 20,1 мкг/мл; AUC 59,1 мкг·час/мл и 55,0 мкг·час / мл; T½ 2,0 ч и 1,7 ч у мужчин и женщин, соответственно, при дозе 400 мг.
Исследования начала 2020 года по лечению фавипиравиром показали его эффективность [25-27]. В России фавипиравир прошел клинические испытания и уже одобрено три его дженерика «Авифавир» (ЛП-006225-290520) [28-30], а также «Арепливир» (ЛП-006288) и «Коронавир» (ЛП-006323).
Сейчас проводится 39 клинических испытаний с фавипиравиром [12].
Более подробно фавипиравир рассмотрен в обзоре.
Сивелестат
Сивелестат (Sivelestat, ONO-5046, Elaspol; CAS 127373-66-4)
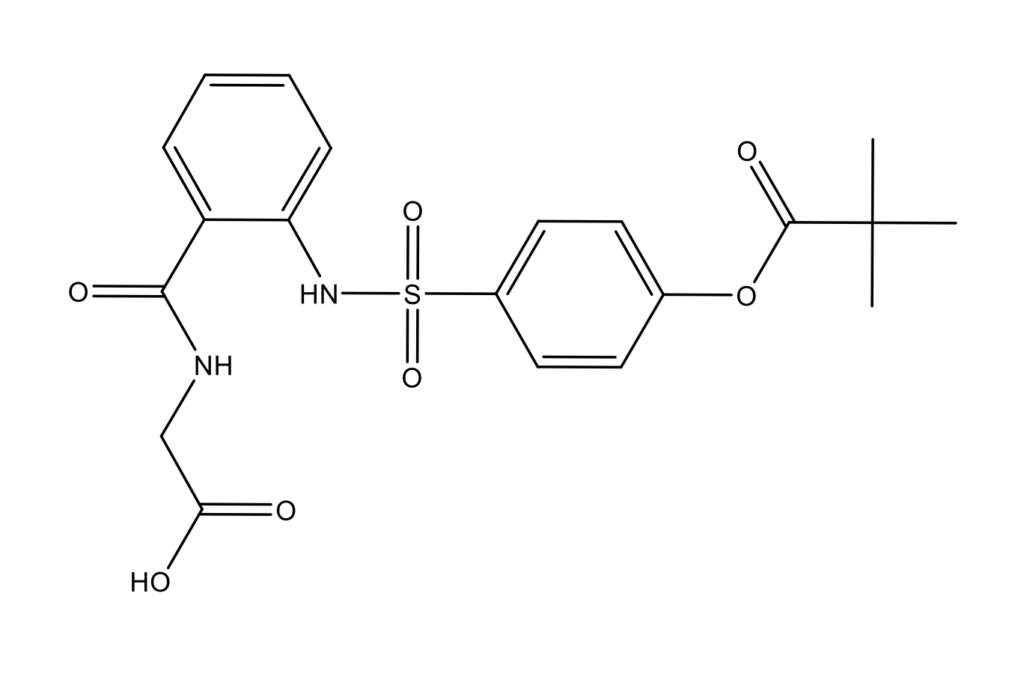
Сивелестат – японский препарат от компании Ono Pharmaceutical Co. Для лечения острой дыхательной недостаточности [31]. Доступны родственные препараты, такие как алидорназа альфа (более эффективный, чем дорназа альфа), сивелестат (ингибитор нейтрофильной эластазы), колхицин (ингибирует как рекрутирование нейтрофилов в места воспаления, так и секрецию IL1β) и анакинра (антагонист рецепторов IL1α и β), которые имеют отличные профили безопасности. Они включены в терапевтические стратегии, доступные сегодня для борьбы с COVID-19.
В статье [32] суммированы эффекты сивелестата при синдроме острого повреждения легких (ALI) / остром респираторном дистресс-синдроме (ARDS) или ARDS с коагулопатией, которые часто наблюдаются у пациентов с COVID-19. Пациенты с COVID-19 более подвержены тромбоэмболическим заболеваниям. В этой связи в различных исследованиях подчеркивалась роль эластазы нейтрофилов (NE) в развитии ДВС-синдрома (диссеминированное внутрисосудистое свертывание, коагулопатия потребления, тромбогеморрагический синдром) у пациентов с ARDS и сепсисом. Было показано, что ингибирование NE сивелестатом смягчает ALI за счет улучшения повреждений альвеолярного эпителия и сосудистого эндотелия, а также обращения вспять повышенной проницаемости сосудов, опосредованной активированными нейтрофилами. Сивелестат является селективным ингибитором NE, и его возможные терапевтические эффекты против инфекции SARS-CoV2 и/или COVID-19 не оценивались. Тем не менее, основываясь на его многообещающих положительных эффектах при основных осложнениях COVID-19, сивелестат можно рассматривать как потенциальное средство для лечения ALI/ARDS или коагулопатии у пациентов с COVID-19.
Сивелестат является селективным, обратимым и конкурентным ингибитором эластазы нейтрофилов. Следовательно, он не влияет на функцию других протеаз в организме. Его защитные эффекты в ослаблении ALI/ARDS были описаны на нескольких моделях повреждения легких. В различных доклинических и животных моделях повреждения легких сивелестат смягчал повышение проницаемости сосудистой сети легких, давление в легочной артерии, увеличение соотношения влажной или сухой массы легочной ткани и количества нейтрофилов. Кроме того, сивелестат улучшает клиренс патогенов, снижает PaO2 и предотвращает переваривание сурфактантного белка D. Тестирование возможной применимости этого терапевтического препарата может помочь в разработке новых стратегий борьбы с COVID-19 [32].
Во время искусственной вентиляции легких, которая требуется при тяжелом течении COVID-19, риск ALI повышается из-за чрезмерной активации эластазы нейтрофилов и миелопероксидазы. Защитные эффекты сивелестата оценивали на животной модели. Мышам вводили сивелестат (100 мг/кг, внутрибрюшинно) или физиологический раствор за 30 минут до вентиляции. За 4 часа вентиляции с высоким дыхательным объемом 20 мл/кг, сивелестат предотвращал гистопатологическое повреждение легких, уменьшал соотношение влажной и сухой массы легочной ткани и подавлял уровни воспалительного белка в сыворотке и жидкости бронхоальвеолярного лаважа (MIP -2), IL-6 и TNF-α [32]. На людях было показано, что сивелестат уменьшал число дней, проведенных с искусственной вентиляцией легких.
Клинические испытания действия сивелестат против COVID-19 пока не проводятся.
Моксифлоксацин
Моксифлоксацин (Moxifloxacin, Avelox, Vigamox, Esthipia, Moxiflox; CAS 151096-09-2)
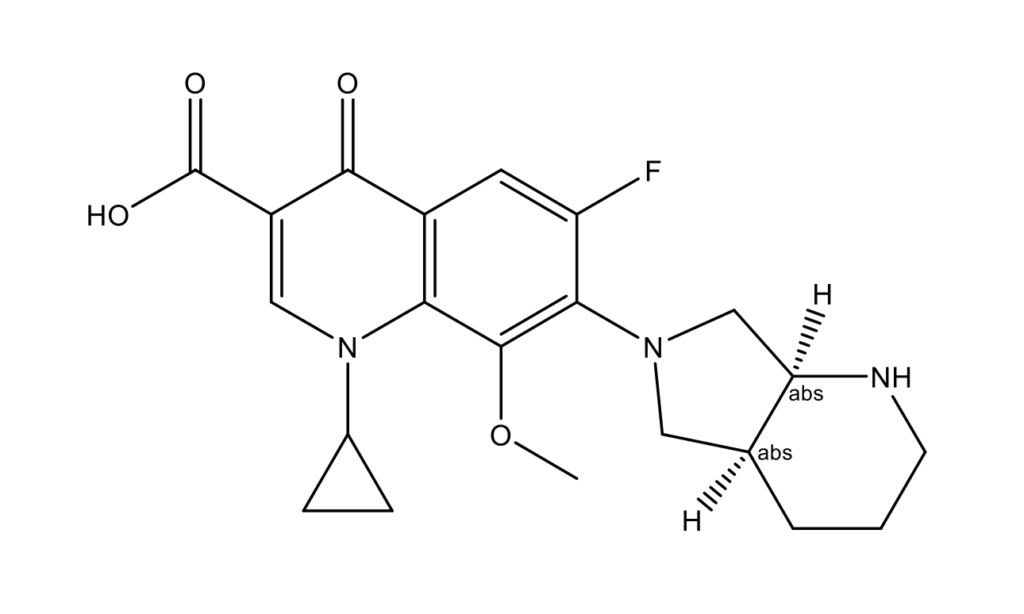
Моксифлоксацин разработан в 1988 году концерном Bayer AG [33]. Фторхинолоны активны в отношении грамотрицательных и грамположительных бактерий, анаэробов, микобактерий и атипичных патогенов. Респираторные фторхинолоны, левофлоксацин и моксифлоксацин являются терапевтическими агентами первой линии для лечения тяжелой внебольничной пневмонии в соответствии с рекомендациями по лечению [34]. Недавнее исследование in silico продемонстрировало, что фторхинолоны, ципрофлоксацин и моксифлоксацин обладают сильной способностью связываться с основной протеазой SARS-CoV-2 (Mpro), что указывает на то, что фторхинолоны могут ингибировать репликацию SARSCoV-2.
Фторхинолоны представляют собой химические производные хинолина. Действительно, соединения на основе хинолина и хинолона исследуются на предмет их противовирусной активности против различных вирусов, таких как Эбола и вирус Денге. Интересно, что фторхинолоны также проявляют противовирусное действие против вируса осповакцины, паповавируса, цитомегаловируса человека, вируса ветряной оспы, вируса простого герпеса типов 1 и 2, вируса гепатита С и ВИЧ.
Учитывая потенциальную противовирусную активность респираторных фторхинолонов против SARS-CoV-2, наряду с их иммуномодулирующими свойствами, благоприятной фармакокинетикой и отличным профилем безопасности, ученые предлагают их использование в качестве дополнительных препаратов при лечении пациентов с COVID-19 [34]. Следовательно, необходимы рандомизированные клинические испытания фторхинолонов для изучения их потенциального терапевтического эффекта в качестве вспомогательного средства при лечении пневмонии, ассоциированной с SARSCoV-2.
В работе [35] по оценке действия комбинации арбидола и моксифлоксацина при COVID-19 собрали и проанализировали данные о 94 пациентах с COVID-19, включая 27 тяжелых и 74 обычных пациентов в больнице Ухань Сихэ. Все пациенты получали арбидол (по 100 мг каждый раз три раза в день в течение 14 дней) и моксифлоксацин (0,4 г каждый раз один раз в день в течение 7–14 дней). По основным характеристикам, тяжелые пациенты были старше (средний возраст составлял 63,0 года против 57,0 лет, имели более высокую долю гипертонии (30% против 9%), более высокую вероятность миалгии (26% против 6%) и имели более очевидный симптом одышки (26% против 3%), более высокое количество лейкоцитов, нейтрофилов. После лечения арбидолом и моксифлоксацином в течение одной недели частота отрицательного теста на SARS-CoV-2 составляла 69,2% в тяжелой группе и 77,8% в обычной. После лечения арбидолом и моксифлоксацином в течение одной недели уровень IL-6 значительно снизился в тяжелой группе. Таким образом, авторы показали, что сочетание арбидола с моксифлоксацином способствует снижению вирусной нагрузки и воспаления у пациентов с COVID-19 [35]. Однако для дальнейших клинических проверок необходимо получить больше доказательств. Недавно стартовало исследование моксифлоксацина NCT02735707, подробности его проведения не указаны [5].
Камостат
Камостат (Camostat, Foipan; CAS 59721-28-7)
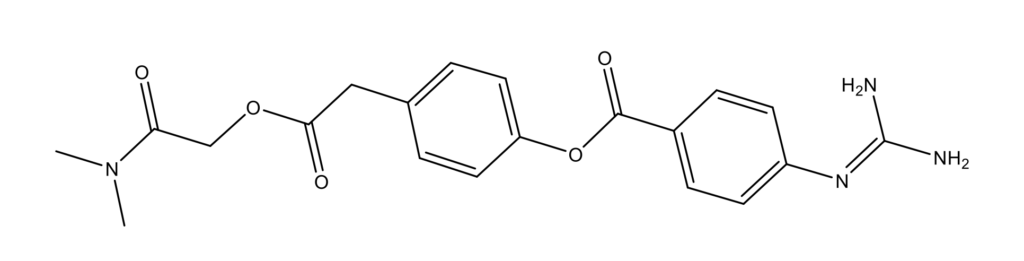
Камостата мезилат был первоначально разработан в 1980-ых годах и в настоящее время одобрен для лечения хронического панкреатита в Японии. Большинство исследований этого соединения были опубликованы на японском языке, за пределами Японии информации доступно мало. Камостат мезилат нацелен на протеазу TMPRSS2, что теоретически предотвращет проникновение вируса. Он снижает количество репликации вируса SARS-CoV-2 [36].
Камостата мезилат блокировал распространение и патогенез SARS-CoV в модели заболевания на мышах, и можно было бы ожидать, что он покажет аналогичный эффект при MERS-CoV. Используя образец вируса SARS-CoV-2, выделенный у пациента, авторы [36] обнаружили, что камостат блокирует проникновение вируса в клетки легких. В эксперименте на мышиной модели камостат был эффективен с выживаемостью 60% в защите животных от гибели после летальной инфекции SARS-CoV. В исследовании вес мышей не описывался, но средний вес оценивался примерно в 20 г. Если предположить, что вес мыши и взрослого человека составляет 20 г и 60 кг, соответственно, то эквивалентная доза камостата для человека будет приблизительно 2,14 мг/кг. Камостат имеет период полураспада в плазме 100 мин и почти полностью выводится за 4–5 часов. Таким образом, ожидается, что ежедневный прием 600 мг (200 мг, три раза) камостата сможет подавлять вирус SARS-CoV-2 [37]. Преимуществом использования камостата для лечения COVID-19 является его низкая стоимость. Однако на сегодняшний день нет клинических данных о применении препарата для блокирования или хотя бы снижения вирусного распространения и патогенеза SARS-CoV-2; клинические испытания на людях только планируются [12].
Лопинавир
Лопинавир (Lopinavir, ABT-378; CAS 192725-17-0)
Препарат был разработан в 1995 году и запатентован компанией Abbott Laboratories [38]. Лопинавир в сочетании с ритонавиром широко используется для лечения COVID-19. Это основной ингибитор Mpro протеазы. Недавние исследования демонстрируют, что лопинавир обладает противовирусной активностью против SARS-CoV-2. Лопинавир жирорастворим, и проникает в спинномозговую жидкость, что существенно уменьшает вирусную нагрузку [39]. Средняя пиковая Cmax при (для 400 мг однократно) ~9,8 мкг/мл, что достигается примерно через 4 часа после введения. Режим дозирования 800 мг по 200 мг один раз в сутки может использоваться для пациентов, ранее не получавших лекарств. Прием пищи не влияет на абсорбцию таблетированной формы. Однако жидкий состав следует принимать с пищей для улучшения абсорбции. Абсолютная биодоступность в организме человека для лопинавира/ритонавира не определена. Средний период полувыведения составляет 2–3 часа после разовой и 4–6 после серии доз. Лопинавир/ритонавир преимущественно выводится фекальным путем, при этом экскреция с мочой составляет <2%. Лопинавир/ритонавир накапливается внутриклеточно. Лопинавир быстро метаболизируется в течение первого прохода в печени за счет CYP3A4 и CYP3A5. Ритонавир подавляет действие CYP3A4 в микросомах печени, что росту концентрации лопинавира.
Ожидается, что лопинавир/ритонавир способен взаимодействовать с лекарствами, метаболизирующимися CYP3A4, CYP3A5, либо влияющими на эти ферменты. Взаимодействие может иметь различные формы: ингибирование противовирусного эффекта лопинавира (рифампицин, зверобой); нежелательные симптомы в сердечно-сосудистой системы (цизаприд, эрготы, статины, пимозид, амиодарон, лидокаин, хинидин, PDE5I), повышение (амиодарон, лидокаин, хинидин, кларитромицин, рифабутин, тразодон) или снижение (фенитоин) уровней этих препаратов в крови; дисульфирамоподобный синдром (метронидазол); подавление надпочечников/остеопороз (флутиказон); усиление угнетения ЦНС (бензодиазепины). С другой стороны, некоторые противовирусные препараты, включая ингибитор протеазы, нуклеозидные и ненуклеозидные ингибиторы обратной транскриптазы, повышают и/или снижают уровни лопинавира/ритонавира в крови [40].
Лопинавир/ритонавир вызывает метаболические изменения, включая гиперлипидемию и непереносимость глюкозы. Он также вызывает дозозависимую (особенно при высоких дозах 800/200 мг) диарею, синдром восстановления иммунитета, проявляющийся в виде воспалительной реакции, гипертриглицеридемии и гиперхолестеринемии [41]. Помимо лопинавира, существует еще несколько ингибиторов протеаз, но с другими механизмами действия.
В базе ClinicalTrials 89 испытаний, где исследуется лопинавир в контексте терапии COVID-19 [12]. О комбинации лопинавир/ритонавир см. выше (Ритонавир).
1. WHO. Weekly operational update on COVID-19 — 30 October 2020; Available from: https://www.who.int/publications/m/item/weekly-operational-update—30-october-2020.
2. Wuhan Coronavirus (2019-nCoV) Global Cases. JHU CSSE. 2020; Available from: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6.
3. Beigel, J.H., Tomashek, K.M., Dodd, L.E., Mehta, A.K., Zingman, B.S., Kalil, A.C., Hohmann, E., Chu, H.Y., Luetkemeyer, A., Kline, S., Lopez de Castilla, D., Finberg, R.W., Dierberg, K., Tapson, V., Hsieh, L., Patterson, T.F., Paredes, R., Sweeney, D.A., Short, W.R., Touloumi, G., Lye, D.C., Ohmagari, N., Oh, M.-d., Ruiz-Palacios, G.M., Benfield, T., Fätkenheuer, G., Kortepeter, M.G., Atmar, R.L., Creech, C.B., Lundgren, J., Babiker, A.G., Pett, S., Neaton, J.D., Burgess, T.H., Bonnett, T., Green, M., Makowski, M., Osinusi, A., Nayak, S., Lane, H.C., Remdesivir for the Treatment of Covid-19 — Final Report. The New England Journal of Medicine, 2020. DOI: 10.1056/NEJMoa2007764.
4. WHO R&D Blueprint – Ad-hoc Expert Consultation on clinical trials for Ebola Therapeutics 2018; Available from: https://www.who.int/ebola/drc-2018/treatments-approved-for-compassionate-use-update/en/.
5. Spinner, C.D., Gottlieb, R.L., Criner, G.J., Arribas López, J.R., Cattelan, A.M., Soriano Viladomiu, A., Ogbuagu, O., Malhotra, P., Mullane, K.M., Castagna, A., Chai, L.Y.A., Roestenberg, M., Tsang, O.T.Y., Bernasconi, E., Le Turnier, P., Chang, S.C., SenGupta, D., Hyland, R.H., Osinusi, A.O., Cao, H., Blair, C., Wang, H., Gaggar, A., Brainard, D.M., McPhail, M.J., Bhagani, S., Ahn, M.Y., Sanyal, A.J., Huhn, G., Marty, F.M., Effect of Remdesivir vs Standard Care on Clinical Status at 11 Days in Patients With Moderate COVID-19: A Randomized Clinical Trial. Jama, 2020. 324(11): p. 1048-1057. DOI: 10.1001/jama.2020.16349.
6. Goldman, J.D., Lye, D.C.B., Hui, D.S., Marks, K.M., Bruno, R., Montejano, R., Spinner, C.D., Galli, M., Ahn, M.Y., Nahass, R.G., Chen, Y.S., SenGupta, D., Hyland, R.H., Osinusi, A.O., Cao, H., Blair, C., Wei, X., Gaggar, A., Brainard, D.M., Towner, W.J., Muñoz, J., Mullane, K.M., Marty, F.M., Tashima, K.T., Diaz, G., Subramanian, A., Remdesivir for 5 or 10 Days in Patients with Severe Covid-19. The New England journal of medicine, 2020. DOI: 10.1056/NEJMoa2015301.
7. AbbVie. 2020; Available from: https://www.abbvie.com/our-science/products.html.
8. Liu, X., Wang, X.-J., Potential inhibitors against 2019-nCoV coronavirus M protease from clinically approved medicines. J Genet Genomics, 2020. 47(2): p. 119-121. DOI: 10.1016/j.jgg.2020.02.001.
9. Zhang, L., Lin, D., Sun, X., Curth, U., Drosten, C., Sauerhering, L., Becker, S., Rox, K., Hilgenfeld, R., Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors. Science, 2020. 368(6489): p. 409-412. DOI: 10.1126/science.abb3405.
10. Deng, L., Li, C., Zeng, Q., Liu, X., Li, X., Zhang, H., Hong, Z., Xia, J., Arbidol combined with LPV/r versus LPV/r alone against Corona Virus Disease 2019: A retrospective cohort study. Journal of Infection, 2020. 81(1): p. e1-e5. DOI: 10.1016/j.jinf.2020.03.002.
11. Cao, B., Wang, Y., Wen, D., Liu, W., Wang, J., Fan, G., Ruan, L., Song, B., Cai, Y., Wei, M., Li, X., Xia, J., Chen, N., Xiang, J., Yu, T., Bai, T., Xie, X., Zhang, L., Li, C., Yuan, Y., Chen, H., Li, H., Huang, H., Tu, S., Gong, F., Liu, Y., Wei, Y., Dong, C., Zhou, F., Gu, X., Xu, J., Liu, Z., Zhang, Y., Li, H., Shang, L., Wang, K., Li, K., Zhou, X., Dong, X., Qu, Z., Lu, S., Hu, X., Ruan, S., Luo, S., Wu, J., Peng, L., Cheng, F., Pan, L., Zou, J., Jia, C., Wang, J., Liu, X., Wang, S., Wu, X., Ge, Q., He, J., Zhan, H., Qiu, F., Guo, L., Huang, C., Jaki, T., Hayden, F.G., Horby, P.W., Zhang, D., Wang, C., A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19. The New England journal of medicine, 2020. 382(19): p. 1787-1799. DOI: 10.1056/NEJMoa2001282.
12. ClinicalTrials. 2020; Available from: https://clinicaltrials.gov/ct2/results?cond=Covid19&term=Camostat
13. Cirino, G., Ahluwalia, A., The many mechanisms of action of Chloroquine: to use or not to use (in COVID-19) that is the question. British journal of pharmacology, 2020. 177(15): p. 3361-3362. DOI: 10.1111/bph.15177.
14. Wang, Q., Zhang, Y., Wu, L., Niu, S., Song, C., Zhang, Z., Lu, G., Qiao, C., Hu, Y., Yuen, K.-Y., Wang, Q., Zhou, H., Yan, J., Qi, J., Structural and Functional Basis of SARS-CoV-2 Entry by Using Human ACE2. Cell, 2020. 181(4): p. 894-904.e899. DOI: 10.1016/j.cell.2020.03.045.
15. Savarino, A., Boelaert, J.R., Cassone, A., Majori, G., Cauda, R., Effects of chloroquine on viral infections: an old drug against today’s diseases. The Lancet Infectious Diseases, 2003. 3(11): p. 722-727. DOI: 10.1016/S1473-3099(03)00806-5.
16. Carew, J.S., Espitia, C.M., Esquivel, J.A., Mahalingam, D., Kelly, K.R., Reddy, G., Giles, F.J., Nawrocki, S.T., Lucanthone Is a Novel Inhibitor of Autophagy That Induces Cathepsin D-mediated Apoptosis. Journal of Biological Chemistry, 2011. 286(8): p. 6602-6613. DOI: 10.1074/jbc.M110.151324.
17. Xue, J., Moyer, A., Peng, B., Wu, J., Hannafon, B.N., Ding, W.-Q., Chloroquine Is a Zinc Ionophore. PLOS ONE, 2014. 9(10): p. e109180. DOI: 10.1371/journal.pone.0109180.
18. Coronavirus (COVID-19) Update: FDA Revokes Emergency Use Authorization for Chloroquine and Hydroxychloroquine. 2020; Available from: https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and.
19. COVID-19: chloroquine and hydroxychloroquine only to be used in clinical trials or emergency use programmes. 2020; Available from: https://www.ema.europa.eu/en/news/covid-19-chloroquine-hydroxychloroquine-only-be-used-clinical-trials-emergency-use-programmes.
20. Physicians work out treatment guidelines for coronavirus. KBR. 2020; Available from: http://www.koreabiomed.com/news/articleView.html?idxno=7428.
21. Hydroxychloroquine Sulfate 2020; Available from: https://www.drugs.com/monograph/hydroxychloroquine-sulfate.html.
22. Zhou, D., Dai, S.-M., Tong, Q., COVID-19: a recommendation to examine the effect of hydroxychloroquine in preventing infection and progression. J Antimicrob Chemother, 2020. 75(7): p. 1667-1670. DOI: 10.1093/jac/dkaa114.
23. Schrezenmeier, E., Dörner, T., Mechanisms of action of hydroxychloroquine and chloroquine: implications for rheumatology. Nature Reviews Rheumatology, 2020. 16(3): p. 155-166. DOI: 10.1038/s41584-020-0372-x.
24. Furuta, Y., Komeno, T., Nakamura, T., Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase. Proceedings of the Japan Academy Series B: Physical and Biological Sciences, 2017. 93(7): p. 449 — 463. DOI: 10.2183/pjab.93.027.
25. Cai, Q., Yang, M., Liu, D., Chen, J., Shu, D., Xia, J., Liao, X., Gu, Y., Cai, Q., Yang, Y., Shen, C., Li, X., Peng, L., Huang, D., Zhang, J., Zhang, S., Wang, F., Liu, J., Chen, L., Liu, L., Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study. Engineering, 2020. DOI: 10.1016/j.eng.2020.03.007.
26. Chemical, F.T. Fujifilm Toyama Chemical’s Favipiravir Shows some Promise in Japanese and Chinese COVID-19 Clinical Trials. 2020; Available from: https://www.trialsitenews.com/fujifilm-toyama-chemicals-favipiravir-shows-some-promise-in-japanese-and-chinese-covid-19-clinical-trials/.
27. Chen, C., Huang, J., Yin, P., Zhang, Y., Cheng, Z., Wu, J., Chen, S., Zhang, Y., Chen, B., Lu, M., Luo, Y., Zhang, J., Wang, X., Favipiravir versus Arbidol for COVID-19: A Randomized Clinical Trial. medRxiv, 2020: p. 2020.2003.2017.20037432. DOI: 10.1101/2020.03.17.20037432.
28. Сурина, Е. Минздрав РФ одобрил первый российский препарат от коронавируса «Авифавир» производства СП РФПИ и ГК «ХимРар». 2020; Available from: https://chemrar.ru/minzdrav-rf-odobril-pervyj-rossijskij-preparat-ot-koronavirusa-avifavir-proizvodstva-sp-rfpi-i-gk-ximrar/.
29. Государственный реестр лекарственных средств. [Access Date: 07.10.2020]; Available from: http://grls.rosminzdrav.ru/grls.aspx.
30. Инструкция по медицинскому применению лекарственного препарата авифавир. Минздрав России
31. Kawabata, K., Suzuki, M., Sugitani, M., Imaki, K., Toda, M., Miyamoto, T., ONO-5046, a novel inhibitor of human neutrophil elastase. Biochemical and Biophysical Research Communications, 1991. 177(2): p. 814-820. DOI: https://doi.org/10.1016/0006-291X(91)91862-7.
32. Sahebnasagh, A., Saghafi, F., Safdari, M., Khataminia, M., Sadremomtaz, A., Ghaleno, H.R., Bagheri, M., Bagheri, M.S., Habtemariam, S., Avan, R., Neutrophil Elastase Inhibitor (Sivelestat), may be a Promising Therapeutic Option for Management of Acute Lung Injury/Acute Respiratory Distress Syndrome or Disseminated Intravascular Coagulation in COVID-19. Authorea Preprints, 2020.
33. CA 1340114 C, 1998.
34. Karampela, I., Dalamaga, M., Could Respiratory Fluoroquinolones, Levofloxacin and Moxifloxacin, Prove to be Beneficial as an Adjunct Treatment in COVID-19? Archives of Medical Research, 2020. DOI: https://doi.org/10.1016/j.arcmed.2020.06.004.
35. Yu, D., Sun, S., Li, Y., Xi, W., Jin, D.I., Sun, K.E., Yu, R., Yao, X., Song, Z., Yang, A., Luo, R., Zou, B., Liu, Y.U.N., Treatment with Arbidol and Moxifloxacin in Ordinary and Severe Adult Patients Infected with COVID-19. medRxiv, 2020: p. 2020.2005.2030.20117598. DOI: 10.1101/2020.05.30.20117598.
36. Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., Schiergens, T.S., Herrler, G., Wu, N.-H., Nitsche, A., Müller, M.A., Drosten, C., Pöhlmann, S., SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell, 2020. 181(2): p. 271-280.e278. DOI: https://doi.org/10.1016/j.cell.2020.02.052.
37. Uno, Y., Camostat mesilate therapy for COVID-19. Intern Emerg Med, 2020: p. 1-2. DOI: 10.1007/s11739-020-02345-9.
38. US 5914332 A, 1999.
39. Letendre, S.L., Brande van den, G., Hermes, A., Woods Paul, S., Durelle, J., Beck, J.M., McCutchan, J.A., Okamoto, C., Ellis, R.J., Group, H.I.V.N.R.C., Lopinavir with Ritonavir Reduces the HIV RNA Level in Cerebrospinal Fluid. Clinical Infectious Diseases, 2007. 45(11): p. 1511-1517. DOI: 10.1086/523002.
40. Chandwani, A., Shuter, J., Lopinavir/ritonavir in the treatment of HIV-1 infection: a review. Ther Clin Risk Manag, 2008. 4(5): p. 1023-1033. DOI: 10.2147/tcrm.s3285.
41. Bongiovanni, M., Chiesa, E., Di Biagio, A., Meraviglia, P., Capetti, A., Tordato, F., Cicconi, P., Biasi, P., Bini, T., d’Arminio Monforte, A., Use of lopinavir/ritonavir in HIV-infected patients failing a first-line protease-inhibitor-containing HAART. J Antimicrob Chemother, 2005. 55(6): p. 1003-1007. DOI: 10.1093/jac/dki113.