НАД+ – ключевой регулятор энергетического обмена в организме. Снижение его уровней в организме связано с многочисленными патологиями, включая нейродегенеративные (например, болезни Альцгеймера и Паркинсона) и сердечно-сосудистые заболевания, диабет, рак и старение. Данный обзор проливает свет на роль НАД+ в функционировании организма, а также рассматривает возможные пути корректировки концентрации НАД+ при патологических состояниях.
NAD+, общие сведения
НАД+ (NAD+, NADox, CO-I, Cozymase, ENADA, Endopride, DPN, Enzopride, NAD trihydrate, Nadide, никотинамидадениндинуклеотид, β-никотинамид-аденин-динуклеотид; C21H28N7O14P2,молекулярная масса 664,4 Да; CAS 53-84-9).
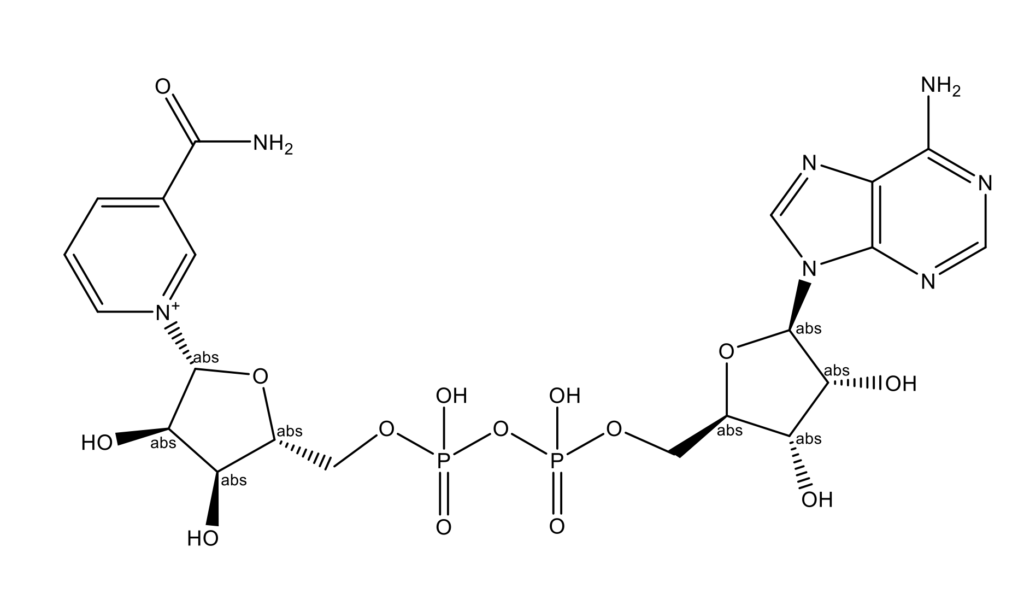
Никотинамидадениндинуклеотид (НАД) представляет собой кофермент, который функционирует в клетках всех организмов как биохимический переносчик электронов. Это органическая молекула, которая может существовать в двух формах: окислитель (НАД+, захватывает электроны) и восстановитель (NADH, NADred, отдает электроны) [1]. Коэнзим НАД был впервые описан в 1906 году британскими биохимиками Артуром Харденом (Arthur Harden) и Уильямом Джоном Янгом (William John Young) [2]. После длительного и сложного процесса очистки Ганс фон Эйлер-Хельпин (Hans von Euler-Chelpin), лауреат Нобелевской премии по химии, смог идентифицировать активное вещество [3].
НАД имеет большое значение во всех метаболических процессах. На молекулярном уровне метаболизм в организме можно рассматривать как последовательность окислительно-восстановительных реакций с непрерывным преобразованием химической энергии. НАД играет ведущую роль в этих реакциях как переносчик электронов. НАД также участвует в репарации ДНК, регуляции экспрессии генов и передаче сигналов. У большинства организмов НАД преимущественно образуется из четырех различных предшественников: триптофана (Trp), никотиновой кислоты (NA), никотинамида (NAM) и никотинамид рибозида (NR). Доминирует синтез de novo, однако существуют и другие пути. Согласно современным представлениям, поддержание концентрации НАД в клетках является определяющим фактором предотвращения старения [4]. NAMPT – фермент, ответственный за превращение NAM в никотинамидмононуклеотид (NMN), который затем превращается в НАД+ [5].
Из НАД образуется никотинамидадениндинуклеотидфосфат (НАДФ) путем добавления фосфатной группы к одной из рибоз. Биологические функции НАДФ похожи на НАД. НАД и НАДФ участвуют в более чем 400 ферментативных реакциях [1]. Общая концентрация НАД, то есть НАД+ и НАДН, колеблется в клетках организма примерно от 0,001 до 1 мМ, большая его часть, до 80%, связана с белками [6]. Соотношение между окисленной и восстановленной формой, НАД+/НАДН, указывает на окислительно-восстановительное состояние клетки – меру метаболической активности и, следовательно, здоровья клетки в данный момент. В здоровых тканях млекопитающих соотношение свободных НАД+/НАДН в цитоплазме составляет около 700 [7]. Дисбаланс соотношения связан с множеством патологических состояний, таких как нейродегенеративные и сердечно-сосудистые заболевания, рак и старение.
С 2000-ых годов все больше внимания уделялось тому факту, что НАД также функционирует как внеклеточная сигнальная молекула в процессах клеточной коммуникации [8]. Обнаружено, что НАД+ высвобождается в небольших количествах из нервных клеток в кровеносных сосудах, мочевом пузыре и толстой кишки, а также из нейросекреторных клеток и синаптосом в головном мозге, поэтому считают, что НАД+ также является нейротрансмиттером [9].
Механизмы действия НАД в организме – важное направление исследований с фармакологической и терапевтической точки зрения. При разработке новых лекарств НАД+ исследуется с использованием трех подходов: как целевое вещество, как эталонная молекула (ведущее соединение) при разработке ферментных ингибиторов НАД-зависимых ферментов, и в ингибировании биосинтеза НАД в антибиотиках [10]. Так, ингибиторы ферментов на основе микофеноловой кислоты подавляют дегидрогеназу IMP в сайте связывания НАД+. Эти ингибиторы ферментов могут использоваться при лечении рака, борьбе с вирусами и в качестве иммунодепрессантов [11]. НАД+ является прямой мишенью антибиотика изониазида, который используется при лечении туберкулеза, инфекционного заболевания, вызываемого бактерией Mycobacterium tuberculosis. Изониазид – пролекарство, которое становится активным только после того, как попадает внутрь микобактерии туберкулеза. Фермент пероксидаза в бактериях окисляет лекарство до свободных радикалов. Изоцианидные радикалы реагируют с НАДН с образованием мощных ингибиторов ферментов, которые блокируют метаболизм патогена [12].
НАД+ и старение
Во время нормального старения более низкие уровни НАД+ наблюдаются в тканях различных организмов, включая человека, мышей (уменьшение на 40% за 10 месяцев) и C. elegans [13]. Некоторые препараты способствуют метаболизму НАД. Сиртуины, в частности, привлекли внимание благодаря их эффекту продления жизни у некоторых животных. Такие молекулы, как ресвератрол, увеличивают активность сиртуина и, таким образом, обладают способностью замедлять старение как у беспозвоночных, так и у модельных позвоночных организмов [14]. Исследование 2013 года подтвердило, что НАД улучшает локализацию белка между ядром клетки и митохондриями, что также приносит пользу здоровью [15].
В 2017 году в экспериментах in vitro и in vivo (на мышах) было продемонстрировано, что НАД участвует в пока еще малоизвестных процессах, влияющих на старение и продолжительность жизни [16]. Исследование показало, что уменьшение репарации ДНК, которое происходит при старении, связано со снижением уровня НАД+ в клетках организма. Изменение взаимодействия между двумя НАД-зависимыми белками, DBC1 и PARP1, считается определяющим фактором процесса старения (из-за их роли в репарации ДНК). Полагают, что регулировка НАД+ может не только предотвратить старение, но и защитить от развития рака и вредного воздействия радиации.
В работе по исследованию старения сообщали, что возрастные дефекты окислительного фосфорилирования (OXPHOS) в скелетных мышцах мышей являются двухфазными [15]. На первом этапе OXPHOS снижается из-за подавления экспрессии генов, кодируемых митохондриями. Лечение мышей среднего возраста (дефекты OXPHOS первой фазы) никотинамидмононуклеотида (NMN) предшественником НАД+, внутрибрюшинно по 500 мг/кг массы тела в день в течение 1 недели, восстанавливает активность окислительного фосфорилирования и другие маркеры митохондриальной функции в скелетных мышцах. Однако сила мышц не восстанавливается. Модель предполагает, что вмешательство в старение митохондрий возможно обусловлено предшественниками НАД+, а восстановление уровня НАД+ может быть полезным для организма. Если двухфазное снижение OXPHOS, наблюдаемое у мышей, сохраняется и для людей, то предотвращение начального уменьшения OXPHOS или обращение вспять первой фазы дисфункции, при которой затрагивается только экспрессия митохондриальных генов, должно привести к значительному антивозрастному эффекту [17]. Долгое время высказывалась гипотеза, что блокирование чрезмерного производства активных форм кислорода (АФК) замедлит старение, и есть по крайней мере один пример, в котором блокирование продукции АФК восстановило аберрантную функцию стволовых клеток у старых мышей [18]. Повышение уровня НАД+ может сохранить митохондриальную функцию у старых мышей, как показано на примере применения NMN по 500 мг/кг/день [19]. При этом, в мышиной модели диабета типа 2 у самок 11 последовательных инъекций NMN полностью нормализовали тяжелое нарушение толерантности к глюкозе. Эти результаты дают информацию о потенциальном нутрицевтическом вмешательстве против диабета 2 типа, вызванного диетой или возрастными изменениями [19].
НАД+ в работе мышц
Увеличение биосинтеза НАД+ с помощью введения промежуточных продуктов или с использованием других подходов может быть стратегией для предотвращения и лечения старения и связанных с возрастом заболеваний [5]. Аэробные упражнения, ограничение калорийности, голодание и низкая доступность глюкозы увеличивают уровни НАД+ (вероятно, за счет увеличения экспрессии гена никотинамидфосфорибозилтрансферазы, NAMPT), повышают активность митохондрий и сиртуинов и снижают уровни НАДН. Известно, что упражнения увеличивают экспрессию NAMPT и, соответственно, НАД+ в скелетных мышцах, что коррелирует с количеством митохондрий. Благоприятные эффекты ограничения калорийности, по-видимому, также зависят от НАД+, а также опосредуются активностью НАД+-зависимого регулятора SIRT1/Sir2. Ограничение калорийности увеличивает продолжительность жизни дрожжей благодаря снижению уровня НАДН, поскольку НАДН является конкурентным ингибитором Sir2, а также за счет снижения уровня NAM [5]. Отметим, что годичное пероральное введение NMN (до 300 мг/кг), как недавно было показано, хорошо переносится без каких-либо очевидных вредных или токсических эффектов у мышей, а уровни НАД+ при этом возрастают до 27% [20].
Простая манипуляция с НАД+ с помощью пищевых добавок или упражнений может иметь потенциал для поддержания здоровья человека. Последнее обусловлено тем, что шесть недель умеренных аэробных упражнений восстанавливают сниженные уровни НАД+ в скелетных мышцах старых (26 месяцев) крыс до уровней, близких к наблюдаемым у молодых животных [21]. Сообщалось также, что упражнения увеличивают концентрацию НАД+ на 20–25% у мышей [22]. Неизвестно, насколько хорошо уровни НАД+ восстанавливаются в тканях, отличных от скелетных мышц. Учитывая участие скелетных и сердечных мышц в старении, возникает соблазн предположить, что положительное влияние упражнений на НАД+ и митохондриальную функцию может быть ограничено типами тканей, непосредственно вовлеченных в процесс. С другой стороны, учитывая хорошо известные, но скромные преимущества упражнений для увеличения продолжительности жизни, можно выдвинуть гипотезу, что модуляция уровней НАД+ является одним из ключевых механизмов пользы упражнений. Наконец, хотя известно, что умеренные упражнения продлевают сохранение здоровья человека и коррелируют с более низкой смертностью в пожилом возрасте, они не предотвращают старение и даже не предотвращают снижение мышечной силы и ловкости. Повышение уровня НАД+ в молодости с помощью упражнений явно недостаточно для обращения вспять связанных со старением дисфункций.
Роль НАД+ в нейродегенеративных заболеваниях
Появляется все больше свидетельств того, что НАД+ может также уменьшить клеточное повреждение при различных дегенеративных заболеваниях, вызванных окислительным стрессом. Было показано, что НАД+ снижает гибель астроцитов in vitro, вызванную PARP1 [23]. PARP1 участвует в патогенезе диабета, болезни Альцгеймера и болезни Паркинсона. Исследования in vitro показали, что НАД+ защищает клетки при использовании 10 мМ даже через 3–4 часа после активации PARP1, таким образом введение НАД+ имеет длительный период окна для уменьшения клеточного повреждения [24]. Кроме того, НАД+ может также повысить жизнеспособность клеток за счет усиления активности сиртуинов и/или улучшения энергетического метаболизма. В то время как участие НАД+ в энергетическом метаболизме и работе митохондрий известно уже довольно давно, предположения об участии НАД+ в репарации ДНК и долголетии появились в последнее десятилетие [25]. Характеристика путей синтеза НАД+ внесла большой вклад в понимание разнообразных ролей пиридиновых нуклеотидов в клеточной биологии.
Для восстановления НАД+ при нейродегенеративных состояниях предложено несколько стратегий, включая применение предшественников НАД+, NR или NMN, ингибиторов PARP1 или активаторов SIRT1 [13]. Увеличение концентрации НАД+ восстанавливает функцию митохондрий и биоэнергетический обмен, что приводит к увеличению выживаемости нейронов и улучшению когнитивной функции в моделях на животных с преждевременным старением. Механизм, лежащий в основе преимуществ увеличения НАД+, вероятно, включает снижение уровней повреждения ДНК, что приводит к снижению активности PARP1. На мышиной модели болезни Альцгеймера применение NR (12 мМ в питьевой воде ad libitum) уменьшало повреждение ДНК и улучшало когнитивные функции на 15–30% [26]. Увеличение НАД+ восстанавливает нейрогенез у мышей, способствуя пролиферации нейральных клеток-предшественников.
Несмотря на это, информация о фундаментальной роли НАД+ в нейродегенерации и старении остается ограниченной. Необходимы дальнейшие исследования в этой актуальной области.
НАД+ и уменьшении воспаления
Последние достижения демонстрируют ключевую роль клеточного метаболизма в программировании иммунных ответов. Клеточно-автономное образование НАД+ посредством кинуренинового пути (КP) регулирует иммунную функцию макрофагов при старении и воспалении [27]. Исследования с помощью изотопных индикаторов показали, что в макрофагах НАД+ в значительной степени является результатом KP-метаболизма триптофана. Генетическая или фармакологическая блокада de novo синтеза НАД+ приводит к истощению подавлению митохондриальной НАД+-зависимой передачи сигналов и дыхания, а также к нарушению фагоцитоза и развитию воспаления. Врожденная иммунная стимуляция запускала активацию вышестоящего КP, но парадоксальным образом подавляла клеточно-автономный синтез НАД+, ограничивая превращение нижестоящего хинолината в НАД+; такой профиль воспроизводится в стареющих макрофагах. Увеличение образования НАД+ de novo в иммунных или старых макрофагах восстанавливает окислительное фосфорилирование и гомеостатические иммунные ответы. Таким образом, KP-производный НАД+ действует как метаболический переключатель, определяющий эффекторные реакции макрофагов. Нарушение синтеза de novo НАД+ может лежать в основе снижения уровней НАД+ и увеличения дисфункции врожденного иммунитета при старении и возрастных заболеваниях [27].
НАД+-зависимое программирование иммунных ответов может привести к лучшему контролю воспаления и фагоцитарной активности, а также к ингибированию старения, связанного с митохондриальной дисфункцией.
НАД+ в клинических исследованиях
Существует вероятность того, что пероральная доставка НАД+ также может быть эффективной. Сам НАД+, по-видимому, может метаболизироваться после перорального введения человеку [28], но его способность изменять внутриклеточные уровни НАД+ в различных типах клеток неизвестна. При этом, с одной стороны, сообщается, что НАД+ in vitro поглощаются многими типами клеток, но с другой – не наблюдалась воспроизводимость этого явления на тех же клеточных линиях, т. е., другие авторы делают вывод, что НАД+ не абсорбируется [29]. Очевидно, что необходимо более подробное изучение поглощения и фармакокинетики НАД+ [17]. В базе ClinicalTrials практически все клинические исследования направлены на изменение уровней НАД+ с помощью введения предшественников этого вещества: триптофана (Trp), никотиновой кислоты, никотинамида, никотинамидмононуклеотида (NMN), никотинамид рибозида (NR) и рибозида никотиновой кислоты (NaR) [30].
Так, для лечения болезни Альцгеймера и легкого когнитивного нарушения предлагают применение NAM по 1500 мг два раза в день перорально (NCT03061474, NCT00580931), NR, 250–1000 мг дважды в день (NCT03482167) или НАДН по 10 мг/день (в/в). Близкие дозировки и в исследованиях болезни Паркинсона (NCT03568968, NCT03816020, NCT03808961). Указанные исследования либо не завершены и настоящему времени, либо результаты не опубликованы.
Единственное исключение, где предполагается использовать непосредственно НАД+ – начинающееся плотное исследование комбинации налтрексона и НАД+ для лечения пациентов с пост-COVID-19 синдромом (NCT04604704). Налтрексон будет использоваться в дозировке 4,5 мг/день, и вводиться перорально в форме капсул. НАД+ будет применяться с использованием пластыря для ионтофореза IontoPatch, содержащего 400 мг раствора НАД+, который будут наносить на кожу в течение 4–6 часов один раз в неделю. В силу актуальности борьбы с последствиями пандемии коронавирусной инфекции, можно предположить, что данное исследование будет проведено достаточно быстро.
Заключение
Системное понижение уровней НАД+ является одним из фундаментальных молекулярных событий, которые регулируют процесс старения и, возможно, ограничивают продолжительность жизни организма. Исследования НАД+ привели к множеству открытий за последние два десятилетия. Идентификация роли НАД+ как кофактора в клеточном дыхании и производстве энергии сопровождалась открытием многочисленных путей биосинтеза НАД+. В последние годы было показано, что НАД+ играет уникальную роль в репарации ДНК и эпигенетическом контроле. Выяснение ключевой роли НАД+ во взаимосвязи ключевых биохимических и клеточных процессов окислительного стресса и активации иммунной системы, энергетического метаболизма, эпигенетического контроля и жизнеспособности клеток при дегенеративных нарушениях и старении, вероятно, будет иметь важное значение для продвижения эффективных методов лечения дегенеративных заболеваний. Поддержание внутриклеточных уровней НАД+ имеет решающее значение для регуляции репарации ДНК, устойчивости к стрессу и гибели клеток, что позволяет предположить, что синтез НАД+ является привлекательной мишенью для терапевтического вмешательства при возрастных дисфункциях. Необходимы дальнейшие исследования, чтобы прояснить условия, при которых следует использовать определенные предшественники НАД+ для эффективного стимулирования внутриклеточного анаболизма НАД+. Сюда следует включать оценку фармакокинетики, безопасности и эффективности для разработки целевых методов лечения, которые ослабляют дегенеративные процессы и помогут поддерживать и улучшить продолжительность сохранения здоровья и обеспечить долголетие. Хотя почти наверняка терапия с помощью коррекции уровней НАД+ сама по себе не является неким «эликсиром жизни», ее основополагающая роль в клеточной энергетике, передаче сигналов и жизнеспособности предполагает, что она могла бы стать ключевым ингредиентом такового.
1. Xiao, W., Wang, R.-S., Handy, D.E., Loscalzo, J., NAD(H) and NADP(H) Redox Couples and Cellular Energy Metabolism. Antioxidants & Redox Signaling, 2017. 28(3): p. 251-272. DOI: 10.1089/ars.2017.7216.
2. Harden, A., Young, W.J., Martin, C.J., The alcoholic ferment of yeast-juice. Part II.—The coferment of yeast-juice. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character, 1906. 78(526): p. 369-375. DOI: 10.1098/rspb.1906.0070.
3. Von Euler-Chelpin, H., Fermentation of sugars and fermentative enzymes. Nobel Lecture, 1930.
4. Aman, Y., Qiu, Y., Tao, J., Fang, E.F., Therapeutic potential of boosting NAD+ in aging and age-related diseases. Translational Medicine of Aging, 2018. 2: p. 30-37. DOI: https://doi.org/10.1016/j.tma.2018.08.003.
5. Poljsak, B., Milisav, I., NAD+ as the Link Between Oxidative Stress, Inflammation, Caloric Restriction, Exercise, DNA Repair, Longevity, and Health Span. Rejuvenation Research, 2016. 19(5): p. 406-413. DOI: 10.1089/rej.2015.1767.
6. Xie, W., Xu, A., Yeung, E.S., Determination of NAD+ and NADH in a Single Cell under Hydrogen Peroxide Stress by Capillary Electrophoresis. Analytical Chemistry, 2009. 81(3): p. 1280-1284. DOI: 10.1021/ac802249m.
7. Williamson, D.H., Lund, P., Krebs, H.A., The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver. Biochemical Journal, 1967. 103(2): p. 514-527. DOI: 10.1042/bj1030514.
8. Billington, R.A., Bruzzone, S., De Flora, A., Genazzani, A.A., Koch-Nolte, F., Ziegler, M., Zocchi, E., Emerging Functions of Extracellular Pyridine Nucleotides. Molecular Medicine, 2006. 12(11): p. 324-327. DOI: 10.2119/2006-00075.Billington.
9. Hwang, S.J., Durnin, L., Dwyer, L., Rhee, P.-L., Ward, S.M., Koh, S.D., Sanders, K.M., Mutafova–Yambolieva, V.N., β-Nicotinamide Adenine Dinucleotide Is an Enteric Inhibitory Neurotransmitter in Human and Nonhuman Primate Colons. Gastroenterology, 2011. 140(2): p. 608-617.e606. DOI: 10.1053/j.gastro.2010.09.039.
10. Khan, J.A., Forouhar, F., Tao, X., Tong, L., Nicotinamide adenine dinucleotide metabolism as an attractive target for drug discovery. Expert Opinion on Therapeutic Targets, 2007. 11(5): p. 695-705. DOI: 10.1517/14728222.11.5.695.
11. Pankiewicz, K.W., Patterson, S.E., Black, P.L., Jayaram, H.N., Risal, D., Goldstein, B.M., Stuyver, L.J., Schinazi, R.F., Cofactor mimics as selective inhibitors of NAD-dependent inosine monophosphate dehydrogenase (IMPDH)—the major therapeutic target. Curr Med Chem, 2004. 11(7): p. 887-900. DOI: 10.2174/0929867043455648.
12. Rawat, R., Whitty, A., Tonge, P.J., The isoniazid-NAD adduct is a slow, tight-binding inhibitor of InhA, the <em>Mycobacterium tuberculosis</em> enoyl reductase: Adduct affinity and drug resistance. Proceedings of the National Academy of Sciences, 2003. 100(24): p. 13881. DOI: 10.1073/pnas.2235848100.
13. Lautrup, S., Sinclair, D.A., Mattson, M.P., Fang, E.F., NAD+ in Brain Aging and Neurodegenerative Disorders. Cell Metabolism, 2019. 30(4): p. 630-655. DOI: https://doi.org/10.1016/j.cmet.2019.09.001.
14. Valenzano, D.R., Terzibasi, E., Genade, T., Cattaneo, A., Domenici, L., Cellerino, A., Resveratrol Prolongs Lifespan and Retards the Onset of Age-Related Markers in a Short-Lived Vertebrate. Current Biology, 2006. 16(3): p. 296-300. DOI: 10.1016/j.cub.2005.12.038.
15. Gomes, Ana P., Price, Nathan L., Ling, Alvin J.Y., Moslehi, Javid J., Montgomery, M.K., Rajman, L., White, James P., Teodoro, João S., Wrann, Christiane D., Hubbard, Basil P., Mercken, Evi M., Palmeira, Carlos M., de Cabo, R., Rolo, Anabela P., Turner, N., Bell, Eric L., Sinclair, David A., Declining NAD+ Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging. Cell, 2013. 155(7): p. 1624-1638. DOI: 10.1016/j.cell.2013.11.037.
16. Li, J., Bonkowski, M.S., Moniot, S., Zhang, D., Hubbard, B.P., Ling, A.J.Y., Rajman, L.A., Qin, B., Lou, Z., Gorbunova, V., Aravind, L., Steegborn, C., Sinclair, D.A., A conserved NAD+ binding pocket that regulates protein-protein interactions during aging. Science, 2017. 355(6331): p. 1312. DOI: 10.1126/science.aad8242.
17. Mendelsohn, A.R., Larrick, J.W., Partial Reversal of Skeletal Muscle Aging by Restoration of Normal NAD+ Levels. Rejuvenation Research, 2014. 17(1): p. 62-69. DOI: 10.1089/rej.2014.1546.
18. Brown, K., Xie, S., Qiu, X., Mohrin, M., Shin, J., Liu, Y., Zhang, D., Scadden, David T., Chen, D., SIRT3 Reverses Aging-Associated Degeneration. Cell Reports, 2013. 3(2): p. 319-327. DOI: https://doi.org/10.1016/j.celrep.2013.01.005.
19. Yoshino, J., Mills, Kathryn F., Yoon, Myeong J., Imai, S.-i., Nicotinamide Mononucleotide, a Key NAD+ Intermediate, Treats the Pathophysiology of Diet- and Age-Induced Diabetes in Mice. Cell Metabolism, 2011. 14(4): p. 528-536. DOI: https://doi.org/10.1016/j.cmet.2011.08.014.
20. Mills, K.F., Yoshida, S., Stein, L.R., Grozio, A., Kubota, S., Sasaki, Y., Redpath, P., Migaud, M.E., Apte, R.S., Uchida, K., Yoshino, J., Imai, S.-i., Long-Term Administration of Nicotinamide Mononucleotide Mitigates Age-Associated Physiological Decline in Mice. Cell Metabolism, 2016. 24(6): p. 795-806. DOI: https://doi.org/10.1016/j.cmet.2016.09.013.
21. Koltai, E., Szabo, Z., Atalay, M., Boldogh, I., Naito, H., Goto, S., Nyakas, C., Radak, Z., Exercise alters SIRT1, SIRT6, NAD and NAMPT levels in skeletal muscle of aged rats. Mechanisms of Ageing and Development, 2010. 131(1): p. 21-28. DOI: https://doi.org/10.1016/j.mad.2009.11.002.
22. Cantó, C., Jiang, L.Q., Deshmukh, A.S., Mataki, C., Coste, A., Lagouge, M., Zierath, J.R., Auwerx, J., Interdependence of AMPK and SIRT1 for Metabolic Adaptation to Fasting and Exercise in Skeletal Muscle. Cell Metabolism, 2010. 11(3): p. 213-219. DOI: https://doi.org/10.1016/j.cmet.2010.02.006.
23. Alano, C.C., Garnier, P., Ying, W., Higashi, Y., Kauppinen, T.M., Swanson, R.A., NAD+; Depletion Is Necessary and Sufficient forPoly(ADP-Ribose) Polymerase-1-Mediated Neuronal Death. The Journal of Neuroscience, 2010. 30(8): p. 2967. DOI: 10.1523/JNEUROSCI.5552-09.2010.
24. Alano, C.C., Ying, W., Swanson, R.A., Poly(ADP-ribose) Polymerase-1-mediated Cell Death in Astrocytes Requires NAD+ Depletion and Mitochondrial Permeability Transition. 2004. 279(18): p. 18895-18902. DOI: 10.1074/jbc.M313329200.
25. Braidy, N., Berg, J., Clement, J., Khorshidi, F., Poljak, A., Jayasena, T., Grant, R., Sachdev, P., Role of Nicotinamide Adenine Dinucleotide and Related Precursors as Therapeutic Targets for Age-Related Degenerative Diseases: Rationale, Biochemistry, Pharmacokinetics, and Outcomes. Antioxidants & Redox Signaling, 2018. 30(2): p. 251-294. DOI: 10.1089/ars.2017.7269.
26. Hou, Y., Lautrup, S., Cordonnier, S., Wang, Y., Croteau, D.L., Zavala, E., Zhang, Y., Moritoh, K., O’Connell, J.F., Baptiste, B.A., Stevnsner, T.V., Mattson, M.P., Bohr, V.A., NAD+; supplementation normalizes key Alzheimer’s features and DNA damage responses in a new AD mouse model with introduced DNA repair deficiency. Proceedings of the National Academy of Sciences, 2018. 115(8): p. E1876. DOI: 10.1073/pnas.1718819115.
27. Minhas, P.S., Liu, L., Moon, P.K., Joshi, A.U., Dove, C., Mhatre, S., Contrepois, K., Wang, Q., Lee, B.A., Coronado, M., Bernstein, D., Snyder, M.P., Migaud, M., Majeti, R., Mochly-Rosen, D., Rabinowitz, J.D., Andreasson, K.I., Macrophage de novo NAD+ synthesis specifies immune function in aging and inflammation. Nature Immunology, 2019. 20(1): p. 50-63. DOI: 10.1038/s41590-018-0255-3.
28. Kimura, N., Fukuwatari, T., Sasaki, R., Shibata, K., Comparison of Metabolic Fates of Nicotinamide, NAD+ and NADH Administered Orally and Intraperitoneally; Characterization of Oral NADH. Journal of Nutritional Science and Vitaminology, 2006. 52(2): p. 142-148. DOI: 10.3177/jnsv.52.142.
29. Nikiforov, A., Dölle, C., Niere, M., Ziegler, M., Pathways and Subcellular Compartmentation of NAD Biosynthesis in Human Cells: FROM ENTRY OF EXTRACELLULAR PRECURSORS TO MITOCHONDRIAL NAD GENERATION. Journal of Biological Chemistry, 2011. 286(24): p. 21767-21778. DOI: 10.1074/jbc.M110.213298.
30. ClinicalTrials. 2020; Available from: https://clinicaltrials.gov/.