Лиофилизация (лиофильная сушка) – широко используемый физический метод обезвоживания различных продуктов, включая лекарственные субстанции, пищу, биологические объекты и пр. Преимуществами такой сушки являются высокая стабильность, пролонгированный срок годности, минимальные изменения свойств, однородность и быстрое восстановление препарата до применимой формы. В данном обзоре рассмотрены основные принципы метода, его положительные и отрицательные стороны, а также некоторые аспекты его применения в производстве.
Многие продукты природного происхождения плохо поддаются хранению в их естественном состоянии. Для повышения срока годности и снижения скорости необратимых изменений, вызванных как физико-химическими, так и биологическими факторами, было разработано множество различных подходов: стерилизация, химическая стабилизация, заморозка и пр. Однако каждый из них имеет свои недостатки, так, например, температурная стерилизация является весьма жестким и деструктивным методом, малоприменимым к термически нестабильным веществам, таким как пептиды и белки. Наиболее важным, с точки зрения здоровья человека, является сохранение качественного и количественного состава высоко биологически активных лекарственных препаратов, поскольку малейшие изменения могут привести не только к утрате ценных свойств, но и резко повысить токсичность или извратить желаемый эффект. Одним из подходящих методов для обработки низкостабильных (лабильных) соединений, позволяющий значительно увеличить срок хранения без потери биологических свойств, является лиофилизация.
Лиофилизация (лиофильная или сублимационная сушка) представляет собой физический метод обработки на основе процесса дегидратации (обезвоживания, или, в общем случае, десольватации вне зависимости от содержащегося растворителя) при охлаждении, и включает в себя заморозку исходного материала, снижение давления и последующее отделение твердого растворителя сублимацией [1]. В отличие сушки большинством традиционных методов, здесь для испарения не используется нагрев раствора. Замораживание для осушки было впервые применено в 1890 г. на образцах растительных или животных сухих тканей немецким профессором Р. Альтманном (Richard Altmann) [2]. Позже была создана камера, в которой вакуум обеспечивался при помощи электрического насоса; затем лиофилизатор был запатентован двумя независимыми изобретателями [3]. С 1950-х годов лиофилизация сформировалась как многоцелевой инструмент для пищевой и фармацевтической промышленности.
Практически, лиофильную сушку можно охарактеризовать как контролируемый метод обезвоживания лабильных продуктов при помощи высушивания в вакууме [1]. Технически, сублимационная сушка может быть разделена на следующие этапы:
- Замораживание водного жидкого образца с превращением его в лед и кристаллизацией кристаллизующихся растворенных веществ, а также образованием аморфной матрицы, содержащей некристаллизующиеся растворенные вещества, связанные с незамерзшей влагой.
- Сублимация замерзшего льда в вакууме.
- Испарение влаги из аморфной матрицы.
- Десорбция хемосорбированной воды.
- Извлечение продукта из прибора.
После первичной сушки, где вода замораживается и удаляется из образца возгонкой, следует вторичная сушка по принципу десорбции. Сублимационная сушка представляет собой процесс, когда вода сублимируется из материала после замораживания для длительного его хранения; процесс применим для производства определенных химикатов, фармацевтических и биологических препаратов, которые являются термолабильными или иным образом нестабильными в водном растворе, но стабильны в обезвоженном состоянии. Лиофилизация проводится при давлении и температуре ниже тройной точки воды, чтобы обеспечить сублимацию льда [1].
Лиофилизация является наиболее распространенным методом, когда проблема хранения вещества заключается в стабильности водного раствора. Это имеет решающее значение для защиты материалов, которые требуют низкого содержания влаги (менее 1%) и бережного стерильного процесса консервации.
Принцип, на котором основана лиофилизация, – это явление, называемое сублимацией, во время которой вода напрямую переходит из твердого состояния (льда) в парообразное, минуя фазу жидкости, и может происходить при параметрах системы ниже тройной точки, т.е. 4,559 мм. рт. и 0,0099 ⁰C [1]. Материал, подлежащий сушке, сначала замораживают, а затем подвергают нагреву (иногда с помощью ИК или микроволнового излучения) в высоком вакууме, так что замороженная жидкость возгоняется, оставляя только твердые, высушенные компоненты исходного раствора. Градиент концентрации водяного пара между фронтом сушки и конденсатором является движущей силой для удаления воды во время лиофилизации.
Основания для применения лиофилизации следующие. Материал химически нестабилен в растворе. Необходим низкотемпературный процесс сушки. Совместимость метода с белковыми фармацевтическими препаратами. Желательна аморфная форма препарата (то есть, обеспечивающая растворимость). Низкое загрязнение частиц. Совместимсть с асептической/стерильной обработкой.
Свойства лиофилизированного продукта таковы. Долговременная стабильность. Минимальное время восстановления. Коммерчески привлекательный внешний вид осадка. Способность сохранять исходные характеристики лекарственной формы при восстановлении, включая свойства раствора, структуру и конформацию белков, дисперсность частиц в суспензии. После восстановления сохраняется изотоничность.
Желательные характеристики продуктов сублимационной сушки: однородный цвет; достаточная сухость и пористость окончательно высушенных продуктов; химическая стабильность продуктов; неповрежденный твёрдый осадок.
Преимущества лиофилизации. Окисляемые вещества хорошо защищены в условиях вакуума. Длительный период консервации благодаря удалению 95–99,5% воды. Точное количество загрузки и равномерное содержание. Незначительное загрязнение вследствие асептического процесса. Минимальные потери летучих химических веществ и чувствительных к нагреванию питательных и ароматных компонентов. Минимальные изменения в свойствах, потому что при низкой температуре подавлены рост микроорганизмов и ферментный эффект. Возможна транспортировка и хранение при нормальной температуре. Быстрое время восстановления. Компоненты высушенного материала остаются однородно диспергированными. Продукт может применяться в жидкой форме. Может быть достигнута и сохранена стерильность продукта.
Недостатки лиофилизации. Летучие соединения могут быть потеряны в высоком вакууме. Требуется дорогостоящее оборудование. Проблемы со стабильностью, связанные с отдельными препаратами. Некоторые сложности, связанные с стерилизацией и обеспечением стерильности камеры сушилки и асептического внесения флаконов в камеру.
Цикл лиофилизации показан на рисунке 1 и состоит из трех этапов: заморозка, первичная и вторичная сушка.
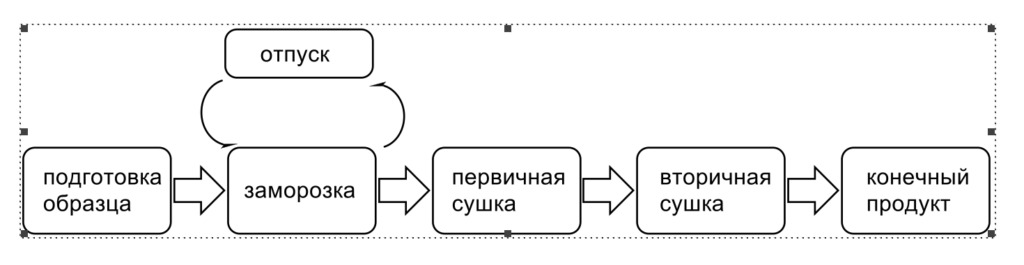
Рисунок 1 – Цикл лиофилизации [1]
Замораживание проводят на подготовительном этапе, так как лиофилизациф подразумевает изменение состояния от твердой к газовой фазе. Особенности протекания заморозки, как и конечная температура замороженного полупродукта, способны влиять на характеристики материала. Быстрое охлаждение способствует получению небольших кристаллов льда, сохраняющих структуру и удобных для микроскопического исследования, но в результате получается образец, который труднее высушить при замораживании. Более медленное охлаждение благоприятствует формированию укрупненных кристаллов и менее ограничивающих каналов в матрице. На замерзание растворов влияет их состав. Большинство продуктов, которые сушат сублимационно, содержат воду, растворитель и растворенные/суспендированные компоненты.
Первичная сушка занимает длительный период времени из-за пониженной температуры камеры и низкого давления паров льда. Сообщалось, что повышение температуры продукта на 1 °C может сократить общее время первичной сушки на целых 13%, что дает огромный потенциал экономии времени и производственных затрат при использовании более агрессивных температур. Однако повышение температуры выше «критической температуры состава», которая относится к температуре плавления эвтектики Teu для кристаллического и Tc или Tg (температуры кристаллизации или стеклования) для аморфных материалов, зачастую приводит к потере структуры осадка. Если критическая температура превышена, то структура высушенных пор вблизи фронта сублимации, которая все еще содержит большое количество воды, может подвергаться вязкому течению, что приводит к слиянию пор и образованию отверстий. Это связано с уменьшением площади внутренней поверхности, а также с повышенным содержанием влаги, что может отрицательно сказаться на времени и полноте восстановления, а также на стабильности препарата. Что наиболее важно, твердый продукт демонстрирует усадку или может полностью разрушиться, что делает его непригодным для продажи или применения у пациентов. Критическую температуру препарата можно определить с помощью микроскопии (FDM), которая позволяет наблюдать структуру сухого вещества под вакуумом при различных температурах. Как только температура схлопывания пор достигнута, можно зафиксировать образование дыр в структуре. Поскольку во время эксперимента образец сушат, то условия достаточно похожи на лиофилизацию, что делает результаты более репрезентативными для процесса сублимации во флаконах. Другой подход для определения критической температуры препарата – дифференциальная сканирующая калориметрия (DSC), где измеряют тепловой поток и тепловые свойства замороженного образца. Таким образом, можно определить температуру стеклования максимально замороженного концентрированного растворенного вещества, Tg. Поскольку удаление воды не происходит, то критическая температура не является столь же типичной для сублимационной сушки, как температура, определенная с использованием FDM. Можно повысить критическую температуру путем количественной кристаллизации солей (то есть, буферов и т. д.) во время замораживания или путем добавления аморфных наполнителей с высокими значениями Tg, таких как декстран или циклодекстрины.
Вторичная сушка необходима, так как после завершения первичной сушки весь лед сублимирован, но связанная влага присутствует в исходном материале. Хотя он и выглядит сухим, но удерживаемая влага может достигать 7–8%, и дальнейшее осушение требует более высокой температуре. Этот процесс называется «изотермическая десорбция». Вторичная сушка, зачастую, продолжается при температурах выше температуры окружающей среды, но совместимой со стабильностью вещества. Десорбционная сушка облегчается путем повышения температуры и снижения давления в камере до минимума. Следует проявлять осторожность при повышении температуры, поскольку результатом ее использования может стать полимеризация или биодеградация белка или пептида. Вторичная сушка обычно проводится в течение приблизительно ⅓–½ времени, необходимого для первичной сушки. Практически, льда больше нет, и поэтому нет никаких опасений по поводу появления «следа таяния», продукт может выдерживать более интенсивный подвод тепла. Кроме того, вода, остающаяся во время вторичной сушки, более прочно связана, что требует больше энергии для ее удаления. Очевидно, что снижение давления в камере до максимально достижимого вакуума способствует десорбции воды.
Важным фактором при лиофилизации белковых и пептидных композиций является долговременная стабильность, которая связана с содержанием воды. В большинстве случаев низкомолекулярные лекарства можно приготовить без наполнителей или просто путем добавления наполнителя или модификатора в жидкую композицию, которая достаточно стабильна, чтобы выдержать необходимую продолжительность замораживания и сушки. Содержание влаги в продуктах обычно достаточно низкое, чтобы гарантировать, что состав остается стабильным в течение длительных периода. Однако для белков ситуация более сложная, потому что они являются лабильными молекулами. Стабильность полипептидов связана с содержанием воды в их составе, но в то же время активная форма белка связана и с конформацией структуры, которой требуется некоторое количество воды для предотвращения денатурации. Этих проблем можно избежать путем оптимизации рецептур и адекватного управления процессом. Концепция стабильности может быть описана как термодинамическая стабильность, обеспечиваемая равновесием между нативными и развернутыми конформациями. Проблема еще более усложняется тем, что, хотя белок может проявлять термодинамическую нестабильность во время сушки вымораживанием и разворачиваться, восстановленный белок может полностью перезаряжаться в течение нескольких секунд и демонстрировать превосходную фармацевтическую стабильность, если не происходит необратимых реакций (например, агрегация) во время хранения или во время восстановления.
Использование криопротекторов бывает необходимым условием для достижения успеха. Криопротектор, как правило, представляет собой вещество, используемое для защиты биологической ткани или природных соединений от повреждения при замерзании (то есть, вследствие образования льда). Наиболее популярными криопротекторами для лиофилизации являются сахара: микоза, сахароза, глюкоза и маннит. Известно, что эти сахара остекловываются при определенной температуре (Tg). Иммобилизация микрочастиц в остеклованной матрице криопротектора может предотвратить их агрегацию и защитить от механического воздействия кристаллов льда. Как правило, замораживание должно проводиться ниже Tg аморфного образца или ниже Teu (температура эвтектической кристаллизации), которая является температурой кристаллизации растворимого компонента в виде смеси со льдом, чтобы обеспечить полное затвердевание образца.
Вспомогательные материалы (эксципиенты) также используются в лиофилизированной рецептуре. Состав водной композиции зависит от требований к активному фармацевтическому ингредиенту (API) и предполагаемого пути введения. Он может состоять из одного или нескольких наполнителей, которые выполняют одну или ряд функций. Эксципиенты могут быть охарактеризованы как буферы, регуляторы pH и тоничности, наполнители и стабилизаторы. Буферы необходимы в фармацевтических составах для стабилизации pH. При разработке лиофилизированных составов, выбор буфера может иметь решающее значение. Фосфатные буферы, особенно фосфат натрия, претерпевают резкие изменения pH во время замораживания. Хорошим подходом считается использование низких концентраций цитратного или гистидинового буфера, который подвергается минимальному изменению рН во время замораживания.
Наполнители предназначены для обеспечения объема препарата. Это важно в тех случаях, когда используются очень низкие концентрации активного ингредиента. Кристаллические наполнители создают структуру осадка с хорошими механическими свойствами. Однако эти материалы также эффективны в стабилизированных продуктах, таких как эмульсии, белки и липосомы, но могут подходить для и для некоторых пептидов. Если кристаллическая фаза является подходящей, можно использовать маннит. Сахароза или один из других дисахаридов могут быть использованы в белковых или липосомных продуктах.
Стабилизаторы являются не только наполнителями, поскольку дисахариды образуют аморфную стеклообразную структуру, которая эффективна для предохранения липосом и белков во время лиофилизации. Сахароза и микоза являются инертными веществами и используются в стабилизирующих составах липосом, белков и вирусов. Глюкоза, лактоза и мальтоза являются восстанавливающими сахарами и могут восстанавливать белки посредством реакции Майяра (реакция сахароаминной конденсации).
Регуляторы тоничности применяют при необходимости получения изотонических составов. Потребность в таком препарате может быть продиктована либо требованиями к стабильности основного раствора, либо к пути введения. Вспомогательные вещества, например, маннит, сахароза, глицин, глицерин и хлорид натрия, являются хорошими регуляторами тоничности. Глицин, дополнительно, может понижать температуру стеклования. Модификаторы тоничности допускается включать в разбавители.
Лиофилизационная аппаратура обеспечивает соответствующие условия: пониженную температуру и давления меньше атмосферного. Ниже приведено общее описание основных компонентов установки и их функций. Общий дизайн лиофилизатора показан на рисунке 2.
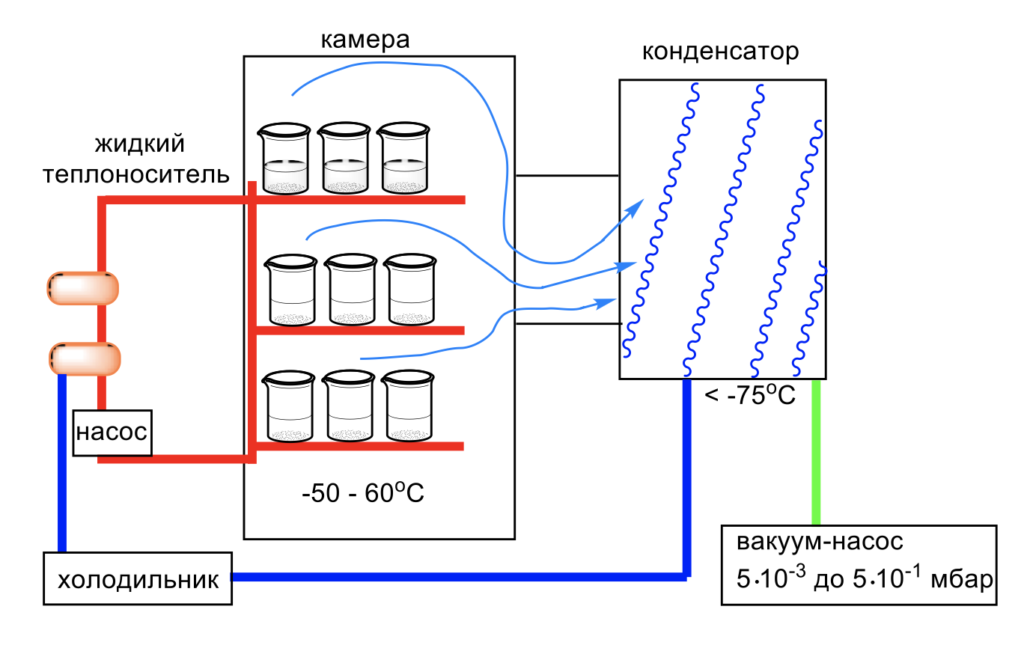
Рисунок 2 – Схема лиофильной установки
Камера представляет собой вакуумный герметичный металлический короб, содержащий полки для размещения обрабатываемого материала, и опционально оснащена системой блокировки. Полки размером до 4 м2 обычно соединены с системой прокачки теплоносителя (силиконовое масло) через фиксированные или гибкие шланги. Конденсатор – холодовая ловушка из змеевиков или других фрагментов с развитой поверхностью, предназначенная для улавливания растворителя при сушке. Теплообмен традиционно осуществляется путем циркуляции жидкости через полки при желаемой температуре. Циркулирующий агент-теплоноситель прокачивают с помощью насоса по герметичному контуру при пониженном давлении. Постоянный цикл изменения температуры иногда приводит к утечке силиконового масла на местах соединений шлангов, загрязняя целевой продукт. Следовательно, необходимо контролировать концентрацию силиконовых паров для своевременного принятия мер и предотвращения загрязнение продукта. Система охлаждения включает в себя использование компрессоров или жидкого азота. Компрессор может выполнять две функции: одну по охлаждению полок, другую – для охлаждения конденсатора возгоняемого растворителя. Вакуумная система позволяет удалить растворитель за разумное время. Требуемый уровень вакуума обычно составляет 50–100 мкбар. Для достижения такого низкого вакуума используется вакуумный роторный насос (обычно двухступенчатый) или несколько насосов.
Использование лиофилизации весьма широко. Фармкомпании зачастую применяют такую сушку с целью увеличения срока годности своих продуктов, вакцин или прочих инъекционных препаратов. Благодаря обезвоживанию материалов и герметизации их во флаконах, препараты можно легко хранить, транспортировать и впоследствии восстанавливать до их первоначальной инъекционной формы. Массовая лиофилизация фармацевтических субстанций проводится на поддонах заместо флаконов из стекла. Лиофилизированные фармпродукты получают как порошки для разведения в стеклянной таре, а в последнее время – и в шприцах-автоинжекторах для самостоятельного применения пациентами. В качестве примеров можно упомянуть различные вакцины от менингококковой инфекции, брюшного тифа, кори, интерферон, стрептокиназу и пр. [4]. В пищевой промышленности лиофилизацию применяют для заготовки продуктов питания с долгим сроком годности и низкой массой. Наиболее востреован такой подход для приготовления запасов пищи для военных, астронавтов, охотников и туристов.
В промышленности, связанной с органическим синтезом, целевые продукты часто сушат вымораживанием для обеспечения повышенной стабильности или для финальной очистки от следов растворителей.
Таким образом, лиофилизация обеспечивает метод сушки температур лабильных материалов, однако она требует серьезных вложений и затрат времени. Аппаратное обеспечение приблизительно троекратно дороже, по сравнению с другими процессами высушивания, а высокие потребности в мощностях приводят к значительным тратам на электроэнергию. Техника лиофилизации оказалась оптимальной для разработки стабильной инъецируемой лекарственной формы, так как содержание влаги в композиции значительно снижено, что повышает стабильность продукта, простоту обращения, обеспечивает быстрое растворение и легкую транспортировку. Около 50% биофармацевтических препаратов в настоящее время подвергают лиофилизации, особенно это касается белковых и пептидных соединений. В лиофилизированном твердом состоянии реакции химической или физической деградации существенно замедляются, что приводит к улучшенной стабильности во времени. Лиофилизация наносит меньший вред препарату сравнительно с другими подходами, где задействованы повышенные температуры, что обуславливает широкую область ее применения. Многие пептидные продукты, например, антитела, требуют именно сублимационной сушки. Кроме того, известные препараты, включая инфликсимаб, ритуксимаб, трастузумаб и этанерцепт, обрабатывают этим методом [4]. Клеточные экстракты и высушенные пробиотики также требуют лиофилизации. В нанотехнологиях лиофилизация применяется в очистке нанотрубок для исключение их агрегации. В бактериологии метод нашел применение для сохранения некоторых штаммов. Некоторые организации исследовали сушку вымораживанием в качестве метода восстановления поврежденных водой книг и документов. Осознание сложности процесса лиофилизации и его влияния на качества продукта и производительность имеет важное значение для успешного применения метода.
1. Khandagale, P.M., Bhairav, B., Saudagar, R.B., Lyophilization Technique: A Review. Asian Journal of Research in Pharmaceutical Sciences, 2016. 6(4): p. 269-276.
2. Meryman, H.T., Historical recollections of freeze-drying. Developments in biological standardization, 1976. 36: p. 29-32.
3. Corver, J., The Evolution of Freeze-Drying. Innovations in Pharmaceutical Technology, 2009. 29: p. 66-70.
4. Freeze-drying. Wikipedia. 2020; Available from: https://en.wikipedia.org/wiki/Freeze-drying#cite_note-30.