Суворексант (Белсомра) – новое эффективное лекарственное средство против бессонницы. Препарат является уникальным представителем ряда двойных антагонистов рецепторов орексина. Данный обзор посвящен клиническим испытаниям безопасности и эффективности суворексанта при лечении бессонницы, его преимуществам и ограничениям.
Бессонница
Проблемы со сном встречаются повсеместно. Сон – уязвимое состояние, которое может нарушаться множеством разнообразных обстоятельств, включая психологические, физиологические и внешние стимулы. Проблемы со сном часто самокорректируются, однако у некоторых людей достижение желаемого качества и количества сна становится постоянной и неприятной задачей. Термин бессонница подразумевает такую триаду обстоятельств: 1) проблемы с засыпанием и/или сном, 2) достаточная возможность для сна и 3) нарушения дневного бодрствования или другие негативные последствия, вызванные проблемным сном [1]. Конкретные жалобы могут включать неудовлетворенность началом сна, его поддержанием и ранним утренним пробуждением. В то время как люди могут описывать в просторечии любое состояние как бессонницу, обозначение расстройства бессонницы зарезервировано для лиц, соответствующих определенным диагностическим критериям.
Расстройство бессонницы в DSM-5 (Диагностическое и статистическое руководство по психическим болезням [2]) требует одновременного присутствия неудовлетворенности сном, наличием возможности для сна, сопутствующего дистресса, частоты не менее трех ночей за неделю, продолжительности более 3 месяцев. Кроме того, нарушения сна не должны объясняться прочими расстройствами, действием веществ или сопутствующим психическим расстройством. Тем не менее, DSM-5 допускает дальнейшее уточнение при выявлении сопутствующей патологии с другими расстройствами сна, психической или медицинской коморбидности. Кроме того, бессонница может быть эпизодической, постоянной или повторяющейся. Более полная и подробная нозология различает три варианта расстройства бессонницы: 1) хроническое, 2) краткосрочное и 3) другое; последнее относится к людям с жалобами на сон, которые не соответствуют всем критериям хронических или краткосрочных расстройств.
Пациент должен сообщить хотя бы об одном из ключевых симптомов, которые включают трудности с началом или поддержанием сна, раннее пробуждение, нежелание ложиться спать по соответствующему расписанию и трудности со сном без постороннего вмешательства. Дополнительные последствия нарушения сна: усталость и/или недомогания; сонливость; снижение концентрации, внимания, проблемы с памятью; ухудшение семейной, социальной жизни, академической или трудовой успеваемости; перепады настроения; поведенческие нарушения (гиперактивность, агрессия, импульсивность); сложности с мотивацией; увеличение количества промашек или ошибок; и чрезмерная озабоченность проблемами сна. Как и в DSM-5, периодичность должна быть не менее трех эпизодов в неделю с продолжительностью от трех месяцев. В МКБ-10 записи о бессоннице находятся в разделах «F» – психические и поведенческие расстройства, «G» – болезни нервной системы [3]. Подробные диагностические критерии не приводятся.
При лечении хронической бессонницы можно использовать различные стратегии. Рекомендации по гигиене сна представляют собой ценную основу для плана лечения, хотя сами по себе они не обязательно решат постоянные проблемы со сном. Тем не менее, улучшение распорядка дня и привычек может помочь создать среду, более благоприятную для начала и поддержания сна, а также для стабилизации циркадного ритма. Следует отметить, что самые современные клинические руководства по фармакологическому лечению бессонницы у взрослых предполагают, что доказательства эффективности, как правило, слабые из-за ограничений исследований и потенциальной систематической ошибки, связанной с их спонсорством [1]. Нарушения сна – явление не новое, как и использование различных веществ для улучшения сна. Использование хлоралгидрата стало широко распространенным в конце 1800-х годов, за ним, с начала 1900-х годов, последовали многочисленные барбитураты и родственные соединения. Риски возникновения зависимости и смертельной передозировки, связанные с большинством лекарств от бессонницы середины века (например, с барбитуратами), приблизили наступление современной эры фармакотерапии бессонницы с помощью бензодиазепинов в 1960–1970-ых годах. Последующие достижения в области нейробиологии позволили значительно расширить понимание регуляции сна, бодрствования и циркадных ритмов. В результате были определены новые фармакологические цели, которые стимулировали разработку новых способствующих засыпанию лекарств. Эволюция фармакотерапии бессонницы была отмечена повышением безопасности при сохранении эффективности.
Люди, страдающие бессонницей, продолжают применять широкий ассортимент препаратов, пытаясь улучшить свой ночной сон и связанные с ним дневные проблемы. Современное разнообразие лекарств для лечения бессонницы позволяет персонализировать терапию согласно индивидуальным симптомам и обстоятельствам пациента. Длинный список препаратов включает снотворные агонисты бензодиазепиновых рецепторов, агонисты рецепторов мелатонина, антагонисты H1-гистаминовых рецепторов, двойные антагонисты рецепторов орексина (гипокретина) [1]. В данном обзоре мы остановимся на известном представителе последних.
Суворексант
Суворексант (Suvorexant, Belsomra™, MK-4305, [5-метил-2-(2H-1,2,3-триазол-2-ил)фенил][(7R)-4-(7-метил-5-хлор-1,3-бензоксазол-2-ил)-1,4-диазепан-1-ил]метанон; CAS 1030377-33-3), единственный одобренный двойной антагонист рецепторов орексина (гипокретина), DORA, доступный в Соединенных Штатах с 2015 года [4] (Рис. 1). Под названием «Белсомра®» препарат получил регистрационное удостоверение для продажи в России (ЛП-004058) [5]. Также суворексант разрешен для применения в Японии [6], Австралии [7] и в Канаде [8]. Показанием для назначения является бессонница, характеризующаяся трудностями с наступлением и/или поддержанием сна [9]. Препарат выпускается в дозировках 5, 10, 15 и 20 мг.
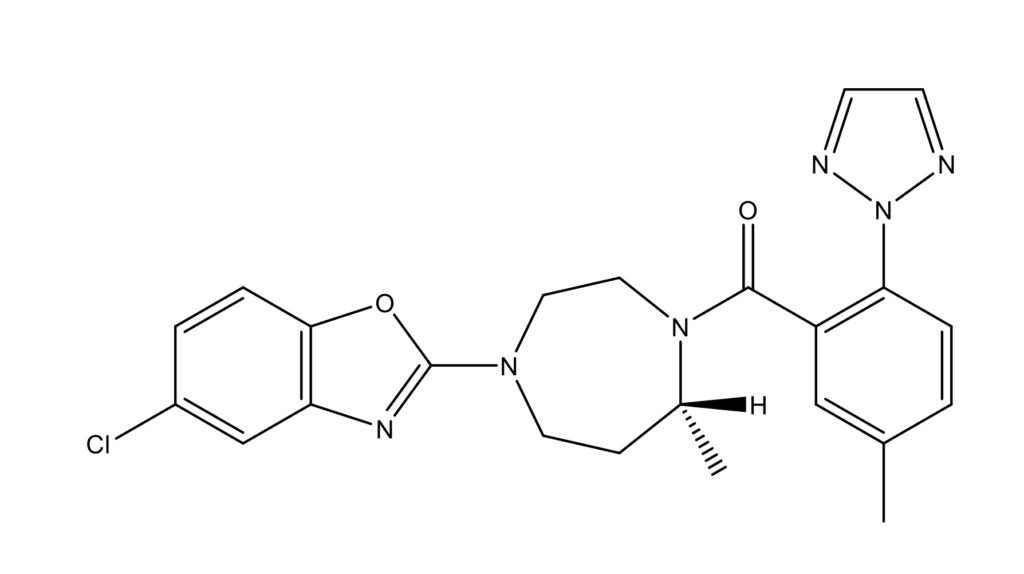
Рисунок 1 – Структурная формула суворексанта
Орексиновая система, играющая важную роль в регуляции цикла сна и бодрствования, на которую нацелен суворексант, была впервые описана в 1998 году. Орексин-A/гипокретин-1 и орексин-B/гипокретин-2 – это нейропептиды, синтезируемые кластером нейронов в латеральном гипоталамусе и перифорникальной области мозга [10]. Орексиновые нейроны получают множество сигналов, связанных с внешними, физиологическими и эмоциональными стимулами, и проецируются на всю ЦНС. Орексиновые нейроны являются многозадачными и регулируют набор жизненно важных функций организма, включая состояния сна/бодрствования, пищевое поведение, энергетический гомеостаз, системы вознаграждения, познание и настроение. Кроме того, дисфункция орексинергической системы может лежать в основе различных патологических состояний. Так, при нарколепсии была обнаружена избирательная потеря орексина нейронами, что подтверждает решающую роль орексинов в поддержании бодрствования. Дефицит орексина приводит к нарушению обучения и памяти, и может вызывать депрессию.
После обнаружения дефицита активности орексина у людей с нарколепсией, была выдвинута гипотеза, что подавление действия орексина может быть полезным для пациентов с бессонницей [1]. Были идентифицированы два рецептора орексина с частично перекрывающимся распределением: OX1R и OX2R. В парадигме этой гипотезы, компания Merck & Co. разработала и синтезировала серию новых антагонистов орексина 1, один из которых стал суворексант; в 2008 году было заявлено о результатах клинических испытаний фазы I [11, 12]. Позже синтез был усовершенствован и перенесен на многокилограммовые загрузки [13].
На основании активности суворексанта в отношении обоих рецепторов, он был определен как двойной антагонист рецепторов орексина (DORA). Клинические испытания суворексанта продемонстрировали его эффективность в улучшении как наступления сна, так и его поддержания [14]. Далее мы рассмотрим ключевые этапы изучения эффективности и безопасности препарата.
Результаты клинических испытаний
Уже к 2014 году было проведено не менее 32 исследований по оценке безопасности и переносимости, фармакокинетики и фармакодинамики суворексанта, включая определение остаточных эффектов, потенциала злоупотребления, безопасности вождения автомобиля [15]. В настоящее время в базу ClinicalTrials внесено 45 испытаний данного препарата [16].
Исследования фазы I были убедительными как с точки зрения эффективности, так и безопасности для применения как у пациентов возраста 18–65 лет, так и пожилых (65 лет и старше) с первичной бессонницей [17]. У молодых здоровых добровольцев после приема 10, 50 и 100 мг суворексанта отмечали, что суворексант не влиял на медленноволновую активность, тогда как были изменены задержка до начала длительного сна (LPS), бодрствование после продолжительного засыпания (WASO), субъективное общее время сна (TST) и эффективность сна (SE), особенно в дозах 50 и 100 мг. Не было оказано влияния на смену стадии, медленный сон (SWS), быстрое движение глаз (REM) или медленные движения глазных яблок (NREM), хотя наблюдалась тенденция к дозозависимому увеличению последних двух параметров. Что касается фармакокинетики, площадь под кривой (AUC) и Cmax увеличивались дозозависимым, но нелинейным образом. Следует отметить, что Tmax составляла 3 часа для трех доз, но с большим разбросом (от 1 до 8). Кроме того, кажущийся конечный период полураспада (T½) колеблется от 9 до 13 часов. Из этих данных ясно, что фармакокинетика не идеальна для снотворного. Tmax достигается через 3 часа, а период полувыведения довольно большой, учитывая, что «нормальная ночь» длится 8 часов. Как оказалось, 100 мг суворексанта через 12 часов приводит к концентрации в плазме, эквивалентной Cmax дозы 50 мг, а через 24 часа – эквивалентна Cmax дозы 10 мг. Авторы пришли к выводу, что у здоровых молодых мужчин без нарушений сна суворексант способствовал засыпанию с признаками остаточных эффектов в самых высоких дозах. Повышенная утомляемость после пробуждения отмечалась при приеме 50 и 100 мг; 100 мг суворексанта увеличивали время, затрачиваемое в тестах на выполнение заданий на реакцию, и некоторые субъекты (20%) сообщали о сонливости на следующее утро при той же дозе, тогда как только 5% – при более низких дозах. В дополнительных исследованиях фармакокинетика суворексанта оценивалась при однократной дозе до 240 мг и при многократной дозе до 100 мг. Расчетное значение Tmax составляет 2 часа с диапазоном 0,5–6 часов; суворексант имеет высокую степень связывания с белками плазмы (99,5%). Метаболизм в основном осуществляется через CYP3A4 (следовательно, ингибиторы или индукторы CYP3A4 влияют на фармкокинетику) и незначительно – через CYP2C19.
Первичная экскреция происходит с фекалиями (примерно 66%) с очень незначительным выведением почками [9]. Биодоступность ~82%. Есть некоторое ограничение абсорбции препарата; AUC и Cmax увеличиваются примерно на 75% при повышении дозы от 10 до 80 мг. Прием пищи отодвигает достижение Cmax.
Исследования фазы II были проведены для подтверждения концепции эффективности и безопасности суворексанта у пациентов с критериями первичной бессонницы по DSM-4 и для определения доз в дальнейших испытаниях фазы III. Результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования (MK4305-P006) были опубликованы в 2012 глду [18]. Пациенты с первичной бессонницей получали одну из четырех доз суворексанта (10, 20, 40 или 80 мг в виде таблеток в течение 4 недель) или плацебо с последующим переходом на плацебо или лекарство, соответственно. Первичным критерием результата было улучшение SE по данным полисомнографии (PSG) в 1,5–2 раза для всех уровней дозировки. Препарат также достиг вторичных конечных точек исследования по улучшению WASO (до -85%) и LPS. Все дозы суворексанта значительно улучшали объективно измеряемое сохранение сна, то есть снижение WASO, как в ночь 1, так и в конце недели 4. Суворексант также улучшил объективно измеряемое начало сна, то есть снижение LPS; однако Cmax (3 часа) объясняет меньшее влияние на LPS, поскольку препарат вводится непосредственно перед сном. Авторы отметили, что анализ конечных точек архитектуры сна показал, что увеличение TST в 2,5 раза для суворексанта по сравнению с плацебо в основном связано с большим временем, проведенным в фазе быстрого сна и, в меньшей степени, во 2-й стадии сна. Латентность REM была уменьшена и NREM – увеличена при всех дозах.
Исследования фазы III (P028 и P029 [19]) были основными исследованиями по подбору доз, в P009 изучали долгосрочную безопасность в период более года [18, 20]. Все три испытания фазы III проводились на лицах молодого, среднего и пожилого (> 65 лет) возраста. В исследование P028 пациенты с бессонницей были рандомизированы для получения одной из двух фиксированных (низкая LD или высокая HD) доз суворексанта или плацебо на 3 месяца. (Для возраста <65 лет LD и HD – 20 и 40 мг, >65 лет – 15 и 30 мг, соответственно).
Пациенты оценивались либо с использованием вопросников, либо с помощью PSG и анкет. Суворексант принимали непосредственно перед сном. Пациентов оценивали на исходном уровне, в ночь 1, в конце недели 1 и месяцев 1, 2 и 3. Всего было рандомизировано 1022 пациента (79 центров по всему миру). Исследование P029 имело дизайн, аналогичный P028. В общей сложности 1019 пациентов были рандомизированы в 90 центров. Возраст пациентов составил от 18 до 86 лет, из них 41% старше 65 лет. Объединенные данные P028 и P029 впечатляют: большинство показателей для поддержания сна и латентного периода сна выполняются в конце 1 недели или после 3 месяцев лечения, хотя в меньшей степени для LPS и sTSO. Однако, архитектуру сна не изучали.
Исследование P009 оценивало долгосрочную безопасность высоких доз суворексанта у субъектов с первичной бессонницей [20]. HD суворексанта составляла 40 мг у пациентов не пожилого возраста и 30 мг – у пожилых. По сравнению с плацебо, большинство результатов были положительными как через 1, так и через 12 месяцев: TST постоянно увеличивался, WASO и TSO – снижались. Во время фазы отмены группа пациентов с суворексантом, которые были переведены на плацебо, показала снижение среднего sTST и увеличение sTSO, которые наблюдались через 1 неделю после прекращения и сохранялись в течение исследования (в других группах не было изменений). Признаков возобновления бессонницы после прекращения приема суворексанта не было ни в одной группе.
Исследования безопасности показали, что побочные эффекты включают сонливость (7–12%), головную боль (7–8%), тошноту (3%), сухость во рту (2–3%), инфекции верхних дыхательных путей (2%), ненормальный сон и кошмары (2–3%) [15]. Вопрос о реакции на дозу особенно важен с учетом данных по безопасности. Суворексант явно вызывал дозозависимые эффекты на следующий день, включая седативный эффект. Восьмикратное увеличение сонливости на следующий день между низкой и высокой дозами суворексанта привело к прекращению приема у 0,2–1,7%. Сонливость продолжала усиливаться в течение как минимум 60 дней после начала лечения. Также наблюдалось увеличение количества случаев сильной сонливости, связанных с дозой. По сути, FDA не считает суворексант в дозах 30 и 40 мг безопасным; 15 и 20 мг имеют эффективность, аналогичную более высоким дозам, и в качестве начальной дозы рекомендуется 10 мг. Компания Merck заявила, что суворексант противопоказан пациентам с нарколепсией.
В двух рандомизированных двойных слепых, плацебо- и активно-контролируемых перекрестных исследованиях оценивали влияние ночного приема суворексанта на способность управлять автомобилем на следующее утро через 9 часов после приема препарата у 24 здоровых пожилых людей (средний возраст 69 лет), получавших 15 мг и 30 мг суворексанта, и 28 субъектов среднего возраста (средний возраст 46 лет), получавших 20 мг и 40 мг суворексанта. Тестирование проводилось через одну ночь и через 8 ночей [21, 22]. Первичным показателем результата было изменение стандартного отклонения положения от полосы движения, показателя эффективности вождения. Анализ показал клинически значимые нарушения вождения у некоторых испытуемых. После одной ночи приема этот эффект наблюдался у лиц пожилого возраста после приема 20 мг или 40 мг суворексанта. Статистически значимого эффекта у пожилых людей не наблюдалось после 15 или 30 мг. В этих двух исследованиях пять субъектов (из них – одна пожилая женщина, принимавшая плацебо) преждевременно прекратили тесты по вождению из-за сонливости. Пациентов, принимающих суворексант в дозе 20 мг, следует предостеречь от вождения на следующий день и других действий, требующих полной сосредоточенности. Пациенты, принимающие более низкие дозы препарата, также должны быть предупреждены о возможности нарушения управления транспортными средствами, поскольку существует индивидуальная чувствительность к суворексанту.
На баланс, память и психомоторные функции у здоровых пожилых людей препарат не влияет. Анализ не показал четких доказательств развития синдрома отмены в общей популяции исследований [23]. Потенциал неклинического злоупотребления суворексантом показан на крысах и резусах [24]. В исследовании предрасположенности к злоупотреблению, проведенном среди потребителей рекреационных наркотиков (n = 36), суворексант (40, 80 и 150 мг) оказывал сходные эффекты с золпидемом (15–30 мг) по субъективным оценкам «пристрастия» и другим параметрам [25]. Лица, склонные к злоупотреблению наркотическими и седативными веществами могут подвергаться повышенному риску злоупотребления и зависимости от суворексанта.
Суворексант не рекомендован при беременности, в период лактации и при нарушениях функций печени [9]. Препарат полностью противопоказан при нарколепсии [9]. Другие ограничения, включая возможные взаимодействия, отражены в инструкции по применению [5]. Лекарственные средства, содержащие суворексант, отпускаются по рецепту врача.
Заключение
Несмотря на известные ограничения, антагонисты рецепторов орексина являются многообещающим направлением для изучения и применения в медицине. Они могут открыть новые терапевтические возможности, особенно при различных типах бессонницы. Учитывая обилие накопленных данных, следует отдать должное команде исследователей Merck за огромную проделанную работу в этой области, которая обеспечила прорыв в понимании механизмов сна и лечении его расстройств.
1. Neubauer, D.N., Chapter 42 — Insomnia Pharmacotherapies: Pharmacodynamics, Strategies, New Directions, and Key Measures in Clinical Trials, in Handbook of Behavioral Neuroscience, H.C. Dringenberg, Editor. 2019, Elsevier. p. 639-648.
2. Diagnostic and statistical manual of mental disorders (DSM-5®). 5 ed. 2013: American Psychiatric Publishing, Inc.. p. 991.
3. International statistical classification of diseases and related health problems: instruction manual. 2 ed. Vol. 2. 2004, Geneva: World Health Organization. p. 131.
4. CY CDER New Molecular Entity (NME) Drug & Original BLA Calendar Year Approvals. 2014 Available from: https://wayback.archive-it.org/7993/20170404174205/https://www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicApprovalReports/NDAandBLAApprovalReports/ucm373420.htm.
5. Суворексант (Suvorexant). 2020; Available from: https://www.rlsnet.ru/mnn_index_id_6783.htm.
6. Asai, Y., Sano, H., Miyazaki, M., Iwakura, M., Maeda, Y., Hara, M., Suvorexant (Belsomra® Tablets 10, 15, and 20 mg): Japanese Drug-Use Results Survey. Drugs in R&D, 2019. 19(1): p. 27-46. DOI: 10.1007/s40268-018-0256-6.
7. AUSTRALIAN PRODUCT INFORMATION BELSOMRA® (suvorexant). 2016; Available from: http://www.guildlink.com.au/gc/ws/msd/pi.cfm?product=mkpbelso.
8. Regulatory Decision Summary — Belsomra — Health Canada. 2018; Available from: https://hpr-rps.hres.ca/reg-content/regulatory-decision-summary-detail.php?lang=en&linkID=RDS00475.
9. BELSOMRA — suvorexant tablet, film coated. 2020; Available from: https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=e5b72731-1acb-45b7-9c13-290ad12d3951.
10. Chieffi, S., Carotenuto, M., Monda, V., Valenzano, A., Villano, I., Precenzano, F., Tafuri, D., Salerno, M., Filippi, N., Nuccio, F., Ruberto, M., De Luca, V., Cipolloni, L., Cibelli, G., Mollica, M.P., Iacono, D., Nigro, E., Monda, M., Messina, G., Messina, A., Orexin System: The Key for a Healthy Life. Front Physiol, 2017. 8: p. 357-357. DOI: 10.3389/fphys.2017.00357.
11. US 7951797 B2, 2008.
12. Cox, C.D., Breslin, M.J., Whitman, D.B., Schreier, J.D., McGaughey, G.B., Bogusky, M.J., Roecker, A.J., Mercer, S.P., Bednar, R.A., Lemaire, W., Bruno, J.G., Reiss, D.R., Harrell, C.M., Murphy, K.L., Garson, S.L., Doran, S.M., Prueksaritanont, T., Anderson, W.B., Tang, C., Roller, S., Cabalu, T.D., Cui, D., Hartman, G.D., Young, S.D., Koblan, K.S., Winrow, C.J., Renger, J.J., Coleman, P.J., Discovery of the Dual Orexin Receptor Antagonist [(7R)-4-(5-Chloro-1,3-benzoxazol-2-yl)-7-methyl-1,4-diazepan-1-yl][5-methyl-2-(2H-1,2,3-triazol-2-yl)phenyl]methanone (MK-4305) for the Treatment of Insomnia. Journal of Medicinal Chemistry, 2010. 53(14): p. 5320-5332. DOI: 10.1021/jm100541c.
13. Baxter, C.A., Cleator, E., Brands, K.M.J., Edwards, J.S., Reamer, R.A., Sheen, F.J., Stewart, G.W., Strotman, N.A., Wallace, D.J., The First Large-Scale Synthesis of MK-4305: A Dual Orexin Receptor Antagonist for the Treatment of Sleep Disorder. Organic Process Research & Development, 2011. 15(2): p. 367-375. DOI: 10.1021/op1002853.
14. Winrow, C.J., Gotter, A.L., Cox, C.D., Doran, S.M., Tannenbaum, P.L., Breslin, M.J., Garson, S.L., Fox, S.V., Harrell, C.M., Stevens, J., Reiss, D.R., Cui, D., Coleman, P.J., Renger, J.J., Promotion of Sleep by Suvorexant—A Novel Dual Orexin Receptor Antagonist. Journal of Neurogenetics, 2011. 25(1-2): p. 52-61. DOI: 10.3109/01677063.2011.566953.
15. Jacobson, L.H., Callander, G.E., Hoyer, D., Suvorexant for the treatment of insomnia. Expert Review of Clinical Pharmacology, 2014. 7(6): p. 711-730. DOI: 10.1586/17512433.2014.966813.
16. СlinicalTrials. 2020; Available from: https://clinicaltrials.gov/ct2/results?cond=&term=suvorexant.
17. Sun, H., Kennedy, W.P., Wilbraham, D., Lewis, N., Calder, N., Li, X., Ma, J., Yee, K.L., Ermlich, S., Mangin, E., Lines, C., Rosen, L., Chodakewitz, J., Murphy, G.M., Effects of suvorexant, an orexin receptor antagonist, on sleep parameters as measured by polysomnography in healthy men. Sleep, 2013. 36(2): p. 259-267. DOI: 10.5665/sleep.2386.
18. Herring, W.J., Snyder, E., Budd, K., Hutzelmann, J., Snavely, D., Liu, K., Lines, C., Roth, T., Michelson, D., Orexin receptor antagonism for treatment of insomnia: a randomized clinical trial of suvorexant. Neurology, 2012. 79(23): p. 2265-2274. DOI: 10.1212/WNL.0b013e31827688ee.
19. Ivgy-May, N., Leibensperger, H., Froman, S., Hutzelmann, J., Snavely, D., Snyder, E., Liu, K., Walsh, J., Roth, T., Michelson, D., Efficacy and safety of suvorexant, an orexin receptor antagonist, in patients with primary insomnia: a 3-month phase 3 trial (trial# 2): P988. Journal of Sleep Research, 2012. 21(1): p. 351-352.
20. Michelson, D., Snyder, E., Paradis, E., Chengan-Liu, M., Snavely, D.B., Hutzelmann, J., Walsh, J.K., Krystal, A.D., Benca, R.M., Cohn, M., Lines, C., Roth, T., Herring, W.J., Safety and efficacy of suvorexant during 1-year treatment of insomnia with subsequent abrupt treatment discontinuation: a phase 3 randomised, double-blind, placebo-controlled trial. The Lancet. Neurology, 2014. 13(5): p. 461-471. DOI: 10.1016/s1474-4422(14)70053-5.
21. Vermeeren, A., Sun, H., Vuurman, E.F.P.M., Jongen, S., Van Leeuwen, C.J., Van Oers, A.C.M., Palcza, J., Li, X., Laethem, T., Heirman, I., Bautmans, A., Troyer, M.D., Wrishko, R., McCrea, J., On-the-Road Driving Performance the Morning after Bedtime Use of Suvorexant 20 and 40 mg: A Study in Non-Elderly Healthy Volunteers. Sleep, 2015. 38(11): p. 1803-1813. DOI: 10.5665/sleep.5168.
22. Vermeeren, A., Vets, E., Vuurman, E.F.P.M., Van Oers, A.C.M., Jongen, S., Laethem, T., Heirman, I., Bautmans, A., Palcza, J., Li, X., Troyer, M.D., Wrishko, R., McCrea, J., Sun, H., On-the-road driving performance the morning after bedtime use of suvorexant 15 and 30 mg in healthy elderly. Psychopharmacology, 2016. 233(18): p. 3341-3351. DOI: 10.1007/s00213-016-4375-x.
23. Gauld, A.R., Suvorexant (Belsomra) for Insomnia. American family physician, 2016. 93(12): p. 1016-1020.
24. Born, S., Gauvin, D.V., Mukherjee, S., Briscoe, R., Preclinical assessment of the abuse potential of the orexin receptor antagonist, suvorexant. Regulatory Toxicology and Pharmacology, 2017. 86: p. 181-192. DOI: https://doi.org/10.1016/j.yrtph.2017.03.006.
25. US 009962387 B2, 2018.