Сахарный диабет – распространенное хроническое метаболическое заболевание. При сахарном диабете типа 2 наблюдается инсулинорезистентность, повышенная выработка глюкозы и дисфункция β-клеток. Оральные глюкозоснижающие ингибиторы дипептидилпептидазы-4 (глиптины) используются для лечения СД2 более десяти лет. Глиптины обладают благоприятным фармакологическим профилем, безопасностью и высокой эффективностью. В обзоре рассмотрены общие свойства глиптинов: нового класса противодиабетических (гипогликемических) препаратов, и их наиболее распространенных представителей: алоглиптина, ситаглиптина, саксаглиптина, вилдаглиптина, линаглиптина и другие.
Сахарный диабет
Диабет – общее название ряда заболеваний, сопровождающихся полиурией. Наиболее распространены две формы диабета: несахарный и сахарный диабет. Первый связан с чрезмерным мочеиспусканием, повышенной жаждой, но нормальным уровнем глюкозы в крови, второй характеризуется повышенным уровнем глюкозы из-за нарушений секреции инсулина и его действия. Сахарный диабет (СД) – это хроническое пожизненное метаболическое заболевание с гипергликемией (высокий уровень глюкозы в крови). СД либо наследуется, либо развивается из-за недостаточной выработки инсулина β-клетками поджелудочной железы. В некоторых случаях наблюдается инсулинорезистентность – состояние, при котором клетки не могут использовать инсулин. Если диабет не лечить, то у пациента может развиться диабетический кетоацидоз, гиперосмолярная кома, сердечно-сосудистые заболевания, цереброваскулярные осложнения, хроническое реноваскулярное заболевание, различные инфекции, включая язвы стопы и прогрессирующее повреждение сетчатки.
К 2014 году 422 миллиона человек в возрасте 18 лет и старше страдали диабетом [1]. В 2015 году от диабета умерло 1,6 миллиона человек. В 2018 году было зафиксировано 500 млн. случаев СД. На диабет 2 типа приходится 90–95% всех случаев диабета у пациентов старше 20 лет, заболевание чаще встречается у взрослых и подростков [2]. Смертельные случаи в основном вызваны осложнениями, связанными с диабетом. Сахарный диабет 1 типа характеризуется аутоиммунным разрушением инсулина. Этиология до сих пор остается неизвестной, и единственным методом лечения являются регулярные инъекции инсулина.
Сахарный диабет 2 (СД2) типа возникает из-за инсулинорезистентности, приводящей к гипергликемии. Состояние можно облегчить с помощью изменений диеты, упражнений и соответствующих лекарств. С развитием фармакологии появились различные классы противодиабетических препаратов, таких как сульфонилмочевины, бигуаниды, ингибиторы альфа-глюкозидазы, тиазолидиндионы, однако они часто вызывают серьезные побочные эффекты, такие как гипогликемия, увеличение веса, сердечно-сосудистые заболевания и проблемы с почками. Недавние достижения в этой области привели к созданию новых противодиабетических средств: миметики инкретина, аналоги амилина и GLP, агонисты PPAR и ингибиторы фермента дипептидилпептидазы-4 (DPP-4), которые демонстрируют более благоприятные токсикологические профили. Ингибиторы DPP-4, или «глиптины», не влияют на вес, представляют меньший риск гипогликемии и обеспечивают долгосрочное регулирование уровня глюкозы после еды.
DPP-4 и глиптины
DPP-4, также известный как аденозиндезаминазный комплексообразующий белок 2 (ADCP 2) или антиген активации Т-клеток CD26, представляет собой сериновую экзопептидазу, присутствующую в эндотелиальных и эпителиальных клетках большинства тканей, которая отщепляет X-пролиновые дипептиды от N-конца полипептидов, включая инкретиновые гормоны кишечника: глюкозозависимый инсулинотропный полипептид (GIP) и глюкагоноподобный пептид-1 (GLP-1), которые отвечают за секрецию инсулина после приема пищи, таким образом поддерживая нормальный уровень глюкозы в крови [1]. Исследования на животных показали, что инкретины ограничивают апоптоз и стимулируют регенерацию β-клеток в поджелудочной железе. Повышение уровней GLP-1 может служить механизмом, лежащим в основе снижения уровня глюкозы в крови. GLP-1 и GIP разрушаются под действием фермента DPP-4 на неактивные метаболиты, что приводит к более короткой продолжительности действия этих гормонов. Ингибиторы DPP-4 продлевают период полураспада GLP-1 и GIP, блокируя фермент DPP-4 и предотвращая их деградацию, тем самым способствуя секреции инсулина β-клетками поджелудочной железы [1].
Одним из безопасных пероральных гипогликемических препаратов (при отсутствии противопоказаний) при СД2 является метформин. Монотерапия пероральными противодиабетическими средствами обычно эффективна, но со временем необходимо добавить второй лекарственный агент для поддержания эугликемии (нормальный уровень глюкозы в крови) [3]. Результаты исследований продемонстрировали, что комбинация метформина и средства, усиливающего секрецию инсулина, понижает уровень HbA1c (гликированный гемоглобин, концентрация которого прямо пропорциональна глюкозе в среднем) на 1,5–2,2% при субоптимальном контроле с помощью диеты и физических упражнений.
Оральные глюкозоснижающие ингибиторы дипептидилпептидазы-4 были введены для лечения СД2 более десяти лет назад. Первыми ингибиторами DPP-4, одобренным Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA, США) стали ситаглиптин, в 2006 году, и саксаглиптин – в 2007 году [3]. Ситаглиптин разрешили к применению для монотерапии и в сочетании с метформином, тиазолидиндионом, сульфонилмочевиной. Вилдаглиптин одобрен в Европе и странах Латинской Америки для использования в комбинации с метформином, тиазолидиндионом, сульфонилмочевиной. Также доступны для использования другие ингибиторы DPP-4 –линаглиптин и алоглиптин.
Исследования доказали, что ингибиторы DPP-4 снижают HbA1c на ~0,6% через 24 недели по сравнению с плацебо. Отметим, что снижение HbA1c на 1% уменьшает на 35% риск развития микрососудистых осложнений. Значительных различий в эффективности ингибиторов DPP-4 при использовании в качестве комбинированной терапии или монотерапии обычно не наблюдается, но эффективность больше у пожилых пациентов с легкой или умеренной гипергликемией натощак. Было показано, что между разными ингибиторами DPP-4 нет серьезных различий в отношении снижения уровня HbA1c [3].
Большинство пациентов с СД2 страдают ожирением и инсулинорезистентностью. Такие препараты, как инсулин и сульфонилмочевина вызывают увеличение веса и, таким образом, создают проблемы при лечении лиц с избыточным весом. Метаанализ показал, что ингибиторы DPP-4 нейтрально влияют на вес [4, 5]. Ингибиторы DPP-4 в комбинации с метформином оказали благоприятное влияние на вес по сравнению с сульфонилмочевиной (-1,92 – -2,34 кг против -1,49 кг) или пиоглитазоном (-2,96 – -4,13кг против -1,78 кг) [6]. Потеря веса улучшает чувствительность к инсулину и предотвращает или замедляет прогрессирование диабета. Потенциальная роль ингибиторов DPP-4 в регуляции массы тела может обеспечить дополнительные терапевтические преимущества помимо их влияния на гликемический контроль.
Испытания показали, что ингибиторы DPP-4 снижают систолическое артериальное давление (АД), улучшают уровень липидов после приема пищи, снижают уровни C-реактивного белка (CRP), оказывают благоприятное действие на дисфункцию эндотелия и уменьшают микроальбуминурию, снижая возможность развития микрососудистых и сердечно-сосудистых патологий [3].
При наличии у пациентов средней и тяжелой почечной недостаточности необходимо корректировать дозы всех ингибиторов DPP-4, кроме линаглиптина. Легкая, умеренная и тяжелая почечная недостаточность определяется клиренсом креатинина 50–80 мл/мин, 30–50 мл/мин и <30 мл/мин, соответственно. Ситаглиптин при сравнении с глипизидом показал сопоставимое снижение HbA1 и альбуминурии при умеренной, тяжелой (RI) и терминальной почечной недостаточности (ESRD). Кроме того, было показаобнаружено, что саксаглиптин вызывает большее понижение HbA1c против плацебо у лиц с умеренной и тяжелой почечной недостаточностью. Вилдаглиптин оказался безопасным и эффективным при RI от легкой до умеренной. Рандомизированные двойные слепые плацебо-контролируемые исследования доказали безопасность и эффективность линаглиптина для гликемического контроля при СД2 с ассоциированной RI [3]. При СД2 и нарушениях функций печени могут быть назначены все ингибиторы DPP-4, кроме вилдаглиптина, из-за его неблагоприятного воздействия. Исследования показали, что ситаглиптин улучшает биохимические и гистологические характеристики неалкогольной жировой болезни печени у пациентов с СД2 типа.
При прогрессировании СД2 у пациентов наблюдается плохой гликемический контроль из-за развития устойчивости к одному пероральному противодиабетическому препарату, что требует добавить второй, чтобы поддерживать уровень глюкозы в течение длительного времени и снизить инсулинорезистентность. В большинстве клинических испытаний комбинированной терапии проверялась безопасность и эффективность введения ингибитора DPP-4 в сравнении с метформиновой монотерапией. Комбинация с ингибитором DPP-4 увеличивает выработку инсулина, что дополнительно усиливает эффект. Ингибиторы DPP-4 с метформином эффективно снижают инсулинорезистентность и выработку глюкозы печенью, что приводит к лучшему гликемическому контролю [7].
В клинических испытаниях чаще всего сообщается о таких нежелательных реакциях ингибиторов DPP-4, как назофарингит, инфекции верхних дыхательных путей, тошнота, диарея, головная боль и болезненность желудка [8]. Риск развития острого панкреатита во время приема ингибиторов DPP-4 неоднозначен. Частота возникновения гипогликемии при использовании любых ингибиторов DPP-4 без одновременного введения инсулина или сульфонилмочевины невелика. Известно о серьезных, но редких аллергических реакциях, включая анафилактоидные, ангионевротический отек и эксфолиативные дерматологические реакции (синдром Стивенса-Джонсона). FDA предупредило о сильной и инвалидизирующей боли в суставах, связанной с ситаглиптином, саксаглиптином, линаглиптином и алоглиптином у восприимчивых пациентов [9]. После внедрения новых пероральных антигипергликемических средств в 2008 году Итальянское медицинское агентство (AIFA) запустило Реестр антидиабетического мониторинга для оценки использования препаратов на основе глиптинов и постмаркетингового наблюдения за безопасностью [10]. Для всех ингибиторов DPP-4 существует низкий потенциал клинически значимых межлекарственных взаимодействий, коррекция дозы не требуется для пожилых пациентов (≥ 65 лет), однако необходима осторожность у больных с острым панкреатитом в анамнезе. При подозрении на панкреатит прием ингибитора DPP-4 следует прекратить.
Рассмотрим особенности главных представителей ингибиторов DPP-4: ситаглиптина, вилдаглиптина, саксаглиптина, линаглиптина и алоглиптина.
Ситаглиптин
Ситаглиптин (Sitagliptin, Januvia, Tesavel, Xelevia,(3R)-3-амино-1-[3- (трифторметил)-5,6-дигидро[1,2,4]триазоло[4,3-a]пиразин-7(8H)-ил]-4-(2,4,5-трифторфенил)-1-бутанон; CAS 486460-32-6)
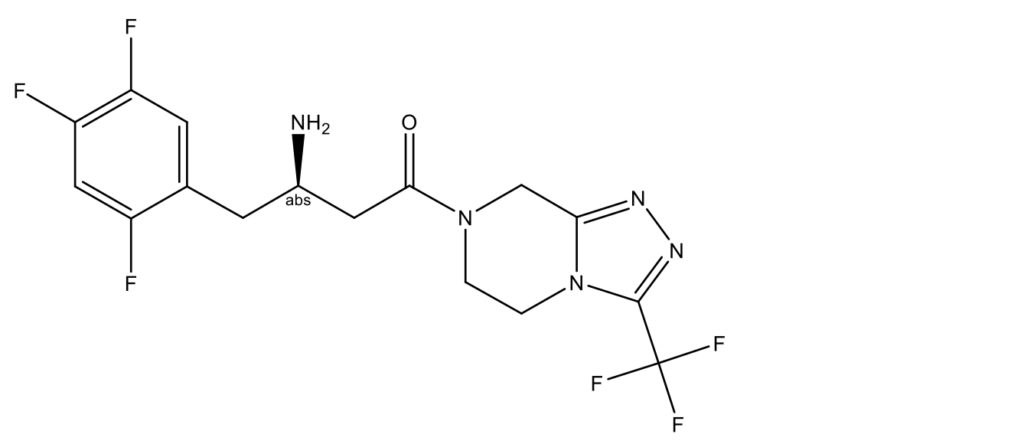
Ситаглиптин от компании Merck – первый появившийся на рынке ингибитор DPP-4. Ситаглиптин является ингибитором DPP-4 длительного действия, поэтому предполагается режим дозирования один раз в день [2]. Ситаглиптин хорошо переносится и вызывает значительное снижение гликемического колебания после перорального теста на толерантность к глюкозе. Уровни интактных GLP-1 и GIP повышаются ингибитором и связаны с увеличением инсулина и снижением концентраций глюкагона. С момента его утверждения в конце 2006 года был опубликован ряд клинических данных.
Из 77864 записей, внесенных в базу AIFA в период с февраля 2008 по август 2010 года, 75283 соответствовали пациентам, принимавшим ингибитор DPP-4 или агонист рецептора GLP-1 сроком 12–104 недели (38811 ситаглиптин, 21064 экзенатид и 17989 вилдаглиптин). Пациенты в возрасте ≥75 лет составляли примерно 10% человек, получавших ингибитор DPP-4. Снижение уровней HbA1c составляло -0,88% и -0,94% для ситаглиптина и вилдаглиптина, соответственно [10]. Вероятность достижения целевого уровня HbA1c 7% для обоих глиптинов быстро снижалась с увеличением исходного HbA1c. Масса тела снизилась при лечении примерно на 1%. Среднее снижение уровней HbA1c до 0,65%, 0,84%, 0,85% и 1,0% наблюдалось после 12 недель, 18 недель, 24 недель и 30 недель испытаний ситаглиптина соответственно [3].
Ингибиторы DPP-4 не были ассоциированы с увеличением частоты нежелательных явлений в метаанализе 58 рандомизированных исследований, ситаглиптин при дозировке 100 мг/день показал наименьшую вероятность гипогликемии и инфекции верхних дыхательных путей [11].
Безопасность ситаглиптина была подтверждена у пожилых пациентов с СД2 (≥ 75 лет) с улучшенными уровнями HbA1c и отсутствием повышенного риска гипогликемии [12]. Апостериорный возрастно-стратифицированный анализ лечения пожилых (65–74 лет [n = 281] и ≥75 [n = 126]) больных с СД2, соблюдавших диету и режим, HbA1c которых был ≥6,9%, несмотря на лечение гипогликемическими средствами, показал, что при применении 100 мг/день ситаглиптина HbA1c значительно снизился от исходного уровня через два года. У субъектов возраста 65–74 лет – с 7,6 до 7,0%; в возрасте ≥75 лет – с 7,7 до 7,1% [12].
Ситаглиптин применяют по 100 мг/день перорально, с едой или без. При использовании с инсулином или же сульфонилмочевиной возможно снизить дозы последних. При легкой степени нарушений функции почек коррекция дозы не требуется, в противном случае дозировку снижают; при тяжелой или ХПН – 25 мг/сутки. Степень нарушения определяется СКФ (скоростью клубочковой фильтрации): от ≥ 60 до <90 мл/мин, от ≥ 30 до <60 мл мин и от ≥15 до <30 мл/мин – легкое, умеренное и тяжелое, соответственно; ТПН соответствует СКФ <15 мл/мин. При печеночной недостаточности легкой и средней степени тяжести коррекции дозы не требуется; при тяжелой – применять с осторожностью. Прием прекращают при подозрении на гиперчувствительность или буллезный пемфигоид.
Клинические испытания фазы III/IV показали, что наиболее частые побочные эффекты – головная боль и гипогликемия при сочетании с сульфонилмочевиной и инсулином. Панкреатит развился у 11,4% (ситаглиптин) против 11,6% (плацебо); сходная частота госпитализаций была по поводу сердечной недостаточности, а также острого панкреатита и рака поджелудочной железы. Отчеты постмаркетингового наблюдения зафиксировали острый панкреатит, реакции гиперчувствительности, артралгию, миалгию, боли в спине, заболевания кожи и подкожной ткани, нарушение функции почек [13].
Ситаглиптин разрешен для применения в России, и фармсубстанция зарегистрирована (гидрохлодрид ФС-002117, фосфата моногидрат ФС-001371).
Вилдаглиптин
Вилдаглиптин (Vildagliptin, Galvus, Jalra, Xiliarx, Zomelis, (2S)-1-[N-(3- гидроксиадамантан-1-ил)глицил]пирролидин-2-карбонитрил; CAS 274901-16-5)
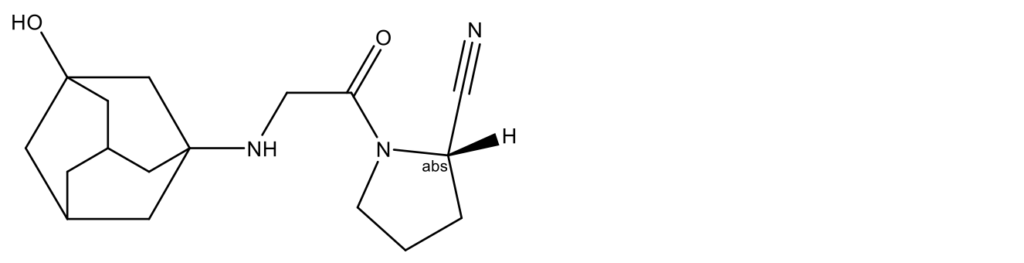
Вилдаглиптин разработан компанией Novartis и имеет более длительный срок действия, чем ситаглиптин, благодаря чему его можно принимать один раз в день. Введение вилдаглиптина снижает концентрации глюкозы натощак и после приема пищи, а также HbA1c, причем поддерживаются уровни инсулина и есть свидетельства того, что вилдаглиптин сохраняет функцию β-клеток [2]. Интересно, что уровни глюкагона были снижены и хорошо коррелировали с улучшением толерантности относительно глюкозы.
Исследования назначения в течение 12 недель вилдаглиптина как монотерапии по 50 мг/день показали устойчивое снижением HbA1c (от исходного уровня 8% до 7,4% к концу исследования) [2]. Особый интерес представляет вывод о том, что пациенты с более высокими исходными уровнями HbA1c (от 8 до 9,5%), отражающими более слабый метаболический контроль, по-видимому, показали наибольшие улучшения по падению HbA1c – в среднем на 1,2%, что свидетельствует о преимуществах препарата. В другом исследовании вилдаглиптин назначался пациентам с СД2 раз в день сроком 12 месяцев, которые уже получали лечение метформином. В первоначальном 12-недельном базовом исследовании уровни HbA1c оставались стабильными, около 7,9%, в группе, получавшей метформин, но у тех, кто принимал вилдаглиптин в сочетании с метформином, достигалось дальнейшее снижение HbA1c на 0,7% и понижение уровня глюкозы натощак на 1,2 ммоль/л. В течение сороканедельного периода вилдаглиптин смог предотвратить ухудшение гликемического контроля, которое произошло в группе, получавшей только метформин, таким образом комбинированное лечение могло повлиять на прогрессирование заболевания. В отличие от аналогов GLP-1 и GLP1, вилдаглиптин не был связан с уменьшением массы тела [2].
В метаанализе вилдаглиптин по 100 мг один раз в день не был связан с увеличением частоты нежелательных явлений и показал низкую вероятность гипогликемии и инфекций верхних дыхательных путей [11]. Лечение вилдаглиптином достигало индивидуализированных целевых уровней гликемии без каких-либо проблем с безопасностью или переносимостью у пожилых пациентов с СД2 [13].
Всемирное реальное обсервационное исследование EDGE было проведено с участием более 45000 пациентов из 27 стран для сравнения эффективности вилдаглиптина в двойной терапии с другими обычно используемыми глюкозоснижающими агентами второй линии, в основном метформин-сульфонилмочевина или комбинации метформин-пиоглитазон [14]. Вилдаглиптин не только снизил уровень HbA1c на 1,19% за 12 месяцев, но и превзошел препараты сравнения в любой момент времени в течение года. Аналогичным образом, субанализ исследования DARWIN-T2D [15] продемонстрировал значительные преимущества ингибиторов DPP-4 с точки зрения снижения HbA1c, глюкозы натощак и массы тела по сравнению с сульфонилмочевиной, гликлазидом, после шестимесячного наблюдения.
Из 17989 записей в базе AIFA по применению вилдаглиптина у пациентов в возрасте ≥75 лет снижение уровня HbA1c в среднем составило -0,94% [10]. Рандомизированное плацебо-контролируемое двойное слепое исследование с участием 276 пациентов с СД2 в возрасте ≥70 лет, которые не получали лечения обычными пероральными противодиабетическими препаратами обнаружило, что субъекты, применявшие вилдаглиптин по 50 мг один–два раза в день лучше достигли своих индивидуальных целевых показателей HbA1c в сравнении с плацебо – 52,6% против 27,0%, соответственно. Клинически значимое снижение HbA1c на 0,9% от исходного значения составило 7,9% на 24 неделе с межгрупповой разницей 0,6% [16].
Анализ мультицентрового ретроспективного наблюдательного исследования показал, что применение вилдаглиптина значительно улучшило лояльность пациента к врачу и готовность выполнять предписания (68,3% против 62,5%), выносливость (61,5% против 55,1%) и метаболический контроль (63,3% против 57,6%), снизилась частота сердечно-сосудистых заболеваний (4,4% против 8,6%) и гипогликемии (17,4% против 42,8%) у пациентов, получавших вилдаглиптин, по сравнению с контрольной группой, где применяли метформин плюс сульфонилмочевина или глитазоны [17]. В исследовании VIVIDD оценивалось влияние 52-недельного лечения вилдаглиптином на фракцию выброса левого желудочка (ФВЛЖ) у 254 больных СД2 и застойной сердечной недостаточностью [18]. Результаты показали отсутствие существенного эффекта на ФВЛЖ, но наблюдалось статистически значимое увеличение конечного диастолического объема левого желудочка при применении вилдаглиптина в сравнении с плацебо.
В метаанализе (40 испытаний, 17446 человек) вилдаглиптин был не связан с повышением риска серьезных неблагоприятных сердечно-сосудистых событий в сравнении с другими применявшимися препаратами (любым агентом, не являющимся вилдаглиптином) [13].
Вилдаглиптин назначают перорально, с едой или без, по 50 мг 1–2 раза в день при использовании в комбинации с сульфонилмочевиной или уменьшают дозировку последней. При легких степенях нарушения работы почек корректировка дозировок не требуется; умеренные или тяжелые – 50 мг/день. При ХПН использовать с осторожностью. При печеночной недостаточности вилдаглиптином применять не следует.
Клинические испытания фазы III/IV продемонстрировали, что нежелательные явления от введения вилдаглиптина преимущественно легкие и преходящие, не требующие отмены препарата. Отмечают исключительные случаи возникновения нарушений функции печени, а также ангионевротического отека (особенно пациенты, принимающие ингибиторы АПФ). Панкреатит при метаанализе 40 исследований фазы III/IV (9599 пациентов, получавших вилдаглиптин) встречался в 0,86% (вилдаглиптин) против 1,20% (препараты сравнение); сердечная недостаточность у 0,43% против 0,45%. Отчеты постмаркетингового наблюдения включают сообщения о панкреатите, гепатите, аномальных функциональных пробах печени, миалгии, крапивнице, эксфолиативных и буллезных поражениях кожи [13].
Вилдаглиптин разрешен к применению в РФ (фармсубстанции ФС-001090, ФС-001974).
Саксаглиптин
Саксаглиптин (Saxagliptin, Onglyza, (1S,3S,5S)-2-[(2S)-2-амино-2-(3-гидроксиадамантан-1-ил)ацетил]-2-азабицикло[3.1.0]гексан-3-карбонитрил; CAS 361442-04-8)
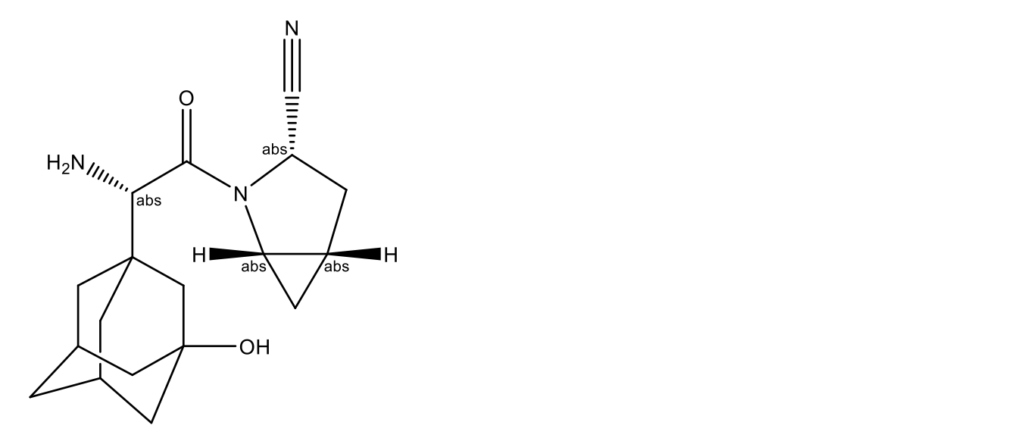
Саксаглиптин разработан компанией Bristol-Myers-Squibb и демонстрирует ингибирование DPP-4 в плазме на более чем 60% на протяжении суток, что достигается однократным приемом 10 мг/кг [2]. Испытания фазы II показали, что препарат вызывает понижение уровня HbA1c на 1% от исходного после восьми недель лечения, причем снижение сохраняется в течение следующих четырех недель. Сообщается, что саксаглиптин хорошо переносится [19].
В 18-недельном испытании сравнивалась эффективность саксаглиптина и ситаглиптина у пациентов с СД2, ранее принимавших метформин с неадекватным гликемическим контролем. Результаты продемонстрировали не меньшую эффективность саксаглиптина (5 мг 1–2 раза в сутки) по сравнению с ситаглиптином (100 мг 1–2 раз в сутки) [20].
Улучшенный гликемический контроль достигнут при использовании саксаглиптина как препарата для монотерапии, дополнительной терапии или начального комбинированного лечения с применением метформина у пожилых с СД2 [21]. Апостериорный анализ результатов пяти 24-недельных многоцентровых рандомизированных исследований фазы III на пациентах возраста >65 лет с СД2 со средним HbA1c, составлявшим 7–10,5%, которые либо не получали препаратов, либо не достигли желаемого гликемического контроля при лечении только метформином, тиазолидиндионом, сульфонилмочевиной, показал, что среднее изменение HbA1c при использовании саксаглиптина по 2,5 мг/день было -0,60% и -0,55% – при дозе 5 мг/день после 24-недельного курса [13].
Было проведено пять крупных плацебо-контролируемых исследований по безопасности назначения саксаглиптина пациентам с СД2, имеющим сердечно-сосудистые проблемы (SAVOR-TIMI 53, ~16500 чел.), алоглиптина (EXAMINE, ~5400 чел.), ситаглиптина (TECOS, ~15000 чел.) и линаглиптина (CARMELINA, 6979 чел.; CAROLINA, ~6000 чел.) [13]. EXAMINE показало эффективность алоглиптина против плацебо и безопасность относительно сердечно-сосудистых осложнений. По результатам SAVOR-TIMI 53 исследователи подтвердили общую безопасность саксаглиптина для пациентов с сердечно-сосудистыми заболеваниями, однако исследователи предупредили о повышении риска госпитализации из-за сердечной недостаточности среди принимавших саксаглиптин.
Саксаглиптин обычно назначают перорально по 5 мг/день, с едой или без. При использовании с сульфонилмочевиной или инсулином рассматривают возможность снижения их дозы. При использовании с мощным индуктором CYP3A4/5 необходимо осуществлять гликемический контроль. Почечная недостаточность умеренной и тяжелой степени требует корректировки до 2,5 мг/день. В случае ТПН препарат не должен назначаться. Тесты функции почек рекомендованы до и во время лечения. Печеночная недостаточность с легкими нарушениями коррекции дозы не требует; при умеренных – применяют с осторожностью; в случае тяжелых – не рекомендуется. Прием прекращают при подозрении на реакции гиперчувствительности. Рекомендовано отслеживание кожных симптомов. Необходима осторожность при наличии у больных опасности госпитализации из-за сердечной недостаточности.
В клинических испытаниях фазы III/IV обнаружили, что наиболее встречающиеся нежелательные реакции включают головную боль, поражение верхних дыхательных или мочевыводящих путей, артралгию, панкреатит. Тяжелые сердечно-сосудистые исходы, включающие инсульт, инфаркт миокарда, смерть и др., наблюдались в 7,3% (саксаглиптин) против 7,2% (плацебо); госпитализации из-за ССЗ происходили у 3,5% против 2,8%. Близкая встречаемость наблюдалась для острого или хронического панкреатита. Отчеты постмаркетинговых наблюдений содержат описание случаев гиперчувствительности, анафилактических реакций, боли в животе, тошноты, панкреатита, сыпи и артралгии [13].
Саксаглиптин доступен в России под названием Онглиза (№ ЛСР-008697/10).
Линаглиптин
Линаглиптин (Linagliptin,Ondero, Tradjenta, 8-[(3R)-3-амино-1-пиперидинил]-7-(2-бутин-1-ил)-3-метил-1-[(4-метил-2-хиназолинил)метил]-3,7-дигидро-1H-пурин-2,6-дион; CAS 668270-12-0)
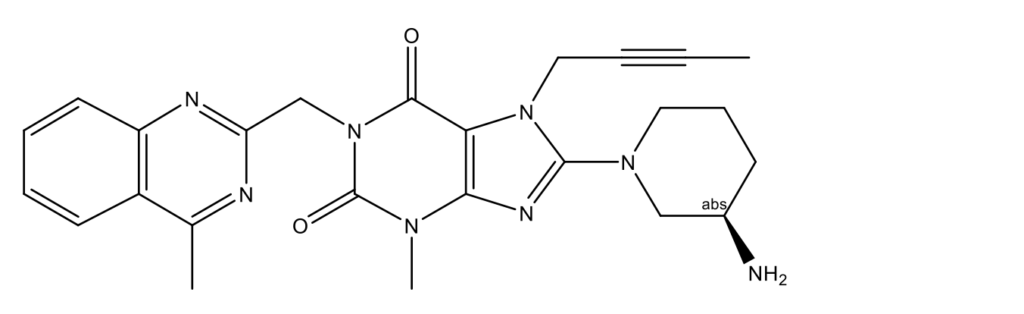
Линаглиптин – продукт компании Eli Lilly. Линаглиптин в дозировке 10 мг/день снижает уровень глюкозы в плазме натощак относительно плацебо, согласно результатам метаанализа [11]. Рандомизированное исследование показало отсутствие значительной разницы между линаглиптином (100 мг/день) и ситаглиптином (5 мг/день): изменение глюкозы составило в среднем –26,1 мг/дл и –19,8 мг/дл, соответственно, после 28 дней лечения [22].
Линаглиптин улучшал гликемию и имел профиль безопасности, аналогичный таковому для плацебо у пожилых пациентов с СД2 с неадекватным, несмотря на прием других глюкозоснижающих препаратов, гликемическим контролем [23]. Линаглиптин также был эффективен для снижения HbA1c, хорошо переносился и, по-видимому, уменьшал возможность возникновения гипогликемии при его добавлении к базальному инсулину [24].
Рандомизированное плацебо-контролируемое исследование фазы III в параллельных группах, где задействовали 241 пациента с СД2, старше 70 лет со средним уровнем HbA1c ≥7% и получающие стабильные количества обычных противодиабетических средств дольше 8 недель, продемонстрировало среднее понижение HbA1c -0,64% у пациентов, использовавших линаглиптин (5 мг/день, 162 человека) относительно начального уровня по прошествии 24 недель [23]. Ретроспективный анализ двух многонациональных двойных слепых плацебоконтролируемых рандомизированных исследований фазы III с параллельными группами (247 человек старше 70 лет с СД2, получающих лечение инсулином и пероральными глюкозоснижающими препаратами или без них) показал изменение HbA1c с линаглиптином от исходного на -0,77% через 24 недели [24].
Исследование CARMELINA продемонстрировало сопоставимую опасность сердечно-сосудистых исходов на протяжении 2,2 года при введении линаглиптина против плацебо при применении линаглиптина совместно со стандартной терапией пациентами с СД2 и имеющимися почечными или сердечно-сосудистыми осложнениями.
Линаглиптин принимают в дозировке 5 мг/день, перорально, с едой или без. При использовании с сульфонилмочевиной или инсулином возможно снизить дозы этих препаратов. Почечная или печеночная недостаточность корректировки не требует. Прием линаглиптина отменяют в случае подозрении развития буллезного пемфигоида.
Клинические испытания фазы III/IV выявили опасность гипогликемии (в тройной комбинации препарата с сульфонилмочевиной, метформином), а также панкреатита. Результаты испытаний CARMELINA показали, сердечно-сосудистые события наблюдались в 12,4% (линаглиптин) против 12,1% (плацебо). Аналогичные показатели были для острого или хронического панкреатита. Отчеты постмаркетингового наблюдения отмечают ангионевротический отек, крапивницу, сыпь, буллезный пемфигоид [13].
В России линаглиптин продается под названием Тражента (№ ЛП-001430).
Алоглиптин
Алоглиптин (Alogliptin, Kazano, Nesina, Vipidia, 2-({6-[(3R)-3- аминопиперидин-1-ил]-3-метил-2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил}метил)бензонитрил; CAS 850649-61-5, бензоат: 850649-62-6)
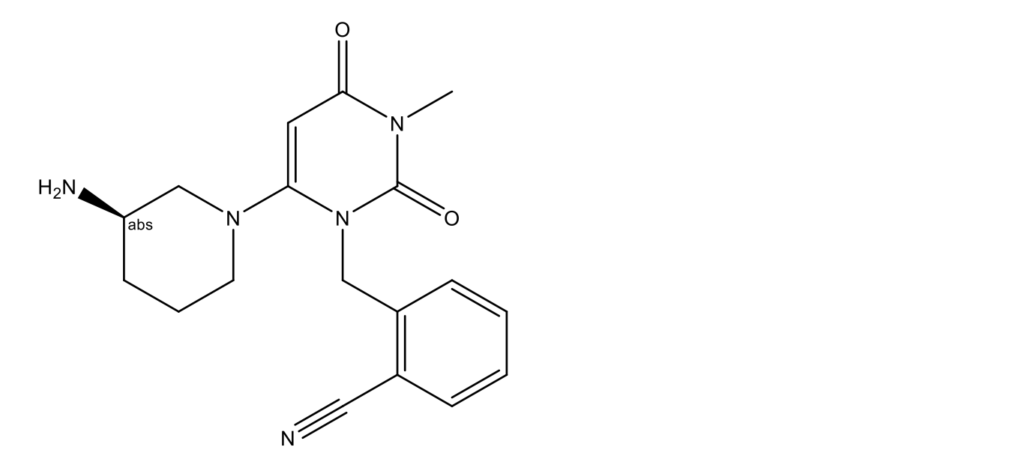
Алоглиптин разработан японской компанией Takeda Pharmaceutical Company.
Глобальное многоцентровое рандомизированное исследование препарата с участием 441 пациента показало, что в дозировке по 25 мг/день алоглиптин в качестве средства пероральной антидиабетической монотерапии не уступает глипизиду (при дозировке 5–10 мг/день) по стойкому и сопоставимому гликемическому контролю у пожилых больных, страдающих легкой гипергликемией [25]. Снижение HbA1c составляло -0,14% в группе назначения алоглиптина (для глипизида – -0,09%). Алоглиптин также привел к благоприятному снижению веса при сравнении относительно глипизида (потеря массы –0,62 кг против -0,60 кг) после курса лечения продолжительностью 52 недели. Алоглиптин эффективен и переносится хорошо пожилыми (старше 65 лет) с СД2 в сравнении с молодыми при аналогичных улучшениях HbA1c и отсутствием повышенной вероятности гипогликемии, увеличения веса или других побочных эффектов [26].
Объединенный анализ [26] шести плацебо-контролируемых рандомизированных испытаний фаз II/III (455 человек, >65 лет, СД2 и неадекватный гликемический контроль) продемонстрировал способность алоглиптина значительно снижать показатель HbA1c через 26 недель – на 0,7% и 0,8% при дозировках алоглиптина 12,5 или 25 мг/день, соответственно. В EXAMINE (~5400 чел.) показали относительную безопасность алоглиптина по вероятности возникновения сердечно-сосудистых исходов при сравнении с контролем [27].
Клинические испытания фазы III/IV выявили, что к распространенному побочному действию относились головные боли. Наступление сердечно-сосудистых исходов исследователями наблюдалось в 11,3% случаев (алоглиптин) против 11,8% у контрольной выборки, такая же частота отмечалась для возникновения панкреатитов. Отчеты постмаркетингового наблюдения зафиксировали реакции гиперчувствительности, острый панкреатит, дисфункцию печени, заболевания кожи или подкожной клетчатки [13].
Алоглиптин принимают по 25 мг/день, перорально, с едой или без. При использовании с сульфонилмочевиной или инсулином, их дозировки можно снижать. Почечная недостаточность в случае легкой степени не требует корректировки дозы; умеренные нарушения – 12,5 мг/день; тяжелые или ХПН – необходимо снижение до 6,25 мг/день. Тесты функции почек следует проводить до лечения и в его процессе. Печеночная недостаточность легкой или средней степени – без корректировки; при тяжелой – алоглиптин не рекомендуется. Больным с симптомами поражения печени следует проходить функциональные пробы.
Субстанция алоглиптина бензоат зарегистрирована в РФ (ФС-001503).
Прочие глиптины
К настоящему времени применяется или находится на различных стадиях разработки и клинических испытаний множество препаратов – ингибиторов DPP-4. Среди них анаглиптин от компаний Kowa Company, Ltd. и Sanwa Kagaku Kenkyusho Co., Ltd., гемиглиптин (LG Life Sciences), омариглиптин (Merck & Co), дутоглиптин (Phenomix Corporation). Гозоглиптин производится и продается под названием Сатерекс в России (№ ЛП-003598). В Японии применяют тенелиглиптин, трелаглиптин. В Южной Корее одобрен эвоглиптин.
Другие вещества, которые способны ингибировать DPP-4, включают алкалоид берберин и многие другие. Так в обзоре [1] приведено более 80 соединений-ингибиторов DPP-4, которые рассматриваются в качестве потенциальных противодиабетических препаратов и относятся к различным классам органических соединений. Эти молекулы содержат такие фрагменты, как бензолсульфонамид, хиназолин, изоксазол, фенилаланин, пиримидиндион, а также комплексы металлов. Некоторые из них показали многообещающие антидиабетические результаты в наномолярном диапазоне концентраций.
Заключение
Сахарный диабет 2 типа характеризуется инсулинорезистентностью, повышенной выработкой глюкозы и дисфункцией β-клеток, следовательно, на эти проблемы необходимо нацелить медикаментозную терапию. Прочие факторы, присутствующие у пациентов, включают избыточный вес, ожирение и ССЗ. Ингибиторы DPP-4 увеличивают выработку инсулина в ответ на прием пищи, уменьшают секрецию глюкагона, сохраняют функцию β-клеток. Глиптины весьма безопасны, хорошо переносимы, а также обеспечивают лучший устойчивый гликемический контроль без опасности развития тяжелой гипогликемии или увеличения веса. Ингибиторы DPP-4 могут, кроме того, снизить риск сердечно-сосудистых исходов, будучи примененными в сочетании с терапией метформином или прочими антидиабетическим средствами. Можно сказать, что глиптины произвели революцию в области лечения СД2. Изучение глиптинов продолжается, равно как и разработка новых, еще более эффективных, соединений. Ожидается, что в обозримом будущем на рынок выйдет еще несколько улучшенных лекарственных средств на основе глиптинов.
Ноотропы оксирацетам и прамирацетам
Акадезин (AICAR) при ишемии, онкологии и в спорте
Лигандрол (Ligandrol, LGD-4033, SARM,САРМ)
Суворексант – новый препарат для лечения бессонницы
Таблетки – заменители физических упражнений
Радарин (Radarine, RAD-140, SARM, САРМ)
1. Rohilla, A., Gupta, T., Pathak, A., Akhtar, M.J., Haider, M.R., Haider, K., Shahar Yar, M., Emergence of promising novel DPP-4 inhibitory heterocycles as anti-diabetic agents: A review. Archiv der Pharmazie, 2018. 351(8): p. 1800127. DOI: https://doi.org/10.1002/ardp.201800127.
2. Sebokova, E., Christ, A., D., Boehringer, M., Mizrahi, J., Dipeptidyl Peptidase IV Inhibitors: The Next Generation of New Promising Therapies for the Management of Type 2 Diabetes. Current Topics in Medicinal Chemistry, 2007. 7(6): p. 547-555. DOI: http://dx.doi.org/10.2174/156802607780091019.
3. Manak, S., Akram, F., Inder, D., Dipeptidyl peptidase-IV (DPP-IV) Inhibitors–a promising oral anti-diabetic drug. Research & Reviews: A Journal of Pharmaceutical Science, 2020. 11(3): p. 1-6.
4. Davidson, J.A., Advances in therapy for type 2 diabetes: GLP-1 receptor agonists and DPP-4 inhibitors. Cleve Clin J Med, 2009. 76 Suppl 5 p. S28-38. DOI: 10.3949/ccjm.76.s5.05.
5. Wu, D., Li, L., Liu, C., Efficacy and safety of dipeptidyl peptidase-4 inhibitors and metformin as initial combination therapy and as monotherapy in patients with type 2 diabetes mellitus: a meta-analysis. Diabetes, Obesity and Metabolism, 2014. 16(1): p. 30-37. DOI: https://doi.org/10.1111/dom.12174.
6. Dicker, D., DPP-4 Inhibitors. Diabetes Care, 2011. 34(Supplement 2): p. S276. DOI: 10.2337/dc11-s229.
7. Cho, Y.Y., Cho, S.-I., Metformin combined with dipeptidyl peptidase-4 inhibitors or metformin combined with sulfonylureas in patients with type 2 diabetes: A real world analysis of the South Korean national cohort. Metabolism, 2018. 85: p. 14-22. DOI: https://doi.org/10.1016/j.metabol.2018.03.009.
8. Sano, M., Mechanism by which dipeptidyl peptidase-4 inhibitors increase the risk of heart failure and possible differences in heart failure risk. Journal of Cardiology, 2019. 73(1): p. 28-32. DOI: https://doi.org/10.1016/j.jjcc.2018.07.004.
9. Smits, M.M., Tonneijck, L., Muskiet, M.H.A., Kramer, M.H.H., Pieters-van den Bos, I.C., Vendrik, K.E.W., Hoekstra, T., Bruno, M.J., Diamant, M., van Raalte, D.H., Cahen, D.L., Pancreatic Effects of Liraglutide or Sitagliptin in Overweight Patients With Type 2 Diabetes: A 12-Week Randomized, Placebo-Controlled Trial. Diabetes Care, 2017. 40(3): p. 301. DOI: 10.2337/dc16-0836.
10. Montilla, S., Marchesini, G., Sammarco, A., Trotta, M.P., Siviero, P.D., Tomino, C., Melchiorri, D., Pani, L., Drug utilization, safety, and effectiveness of exenatide, sitagliptin, and vildagliptin for type 2 diabetes in the real world: Data from the Italian AIFA Anti-diabetics Monitoring Registry. Nutrition, Metabolism and Cardiovascular Diseases, 2014. 24(12): p. 1346-1353. DOI: 10.1016/j.numecd.2014.07.014.
11. Ling, J., Cheng, P., Ge, L., Zhang, D.-h., Shi, A.-c., Tian, J.-h., Chen, Y.-j., Li, X.-x., Zhang, J.-y., Yang, K.-h., The efficacy and safety of dipeptidyl peptidase-4 inhibitors for type 2 diabetes: a Bayesian network meta-analysis of 58 randomized controlled trials. Acta Diabetologica, 2019. 56(3): p. 249-272. DOI: 10.1007/s00592-018-1222-z.
12. Umezawa, S., Kubota, A., Maeda, H., Kanamori, A., Matoba, K., Jin, Y., Minagawa, F., Obana, M., Iemitsu, K., Ito, S., Amamiya, H., Kaneshiro, M., Takai, M., Kaneshige, H., Hoshino, K., Ishikawa, M., Minami, N., Takuma, T., Sasai, N., Aoyagi, S., Kawata, T., Mokubo, A., Miyairi, Y., Takeda, H., Honda, S., Machimura, H., Motomiya, T., Waseda, M., Naka, Y., Tanaka, Y., Terauchi, Y., Matsuba, I., Two-year assessment of the efficacy and safety of sitagliptin in elderly patients with type 2 diabetes: Post hoc analysis of the ASSET-K study. BMC Endocrine Disorders, 2015. 15(1): p. 34. DOI: 10.1186/s12902-015-0033-2.
13. Sesti, G., Avogaro, A., Belcastro, S., Bonora, B.M., Croci, M., Daniele, G., Dauriz, M., Dotta, F., Formichi, C., Frontoni, S., Invitti, C., Orsi, E., Picconi, F., Resi, V., Bonora, E., Purrello, F., Ten years of experience with DPP-4 inhibitors for the treatment of type 2 diabetes mellitus. Acta Diabetologica, 2019. 56(6): p. 605-617. DOI: 10.1007/s00592-018-1271-3.
14. Mathieu, C., Barnett, A.H., Brath, H., Conget, I., de Castro, J.J., Göke, R., Márquez Rodriguez, E., Nilsson, P.M., Pagkalos, E., Penfornis, A., Schaper, N.C., Wangnoo, S.K., Kothny, W., Bader, G., Effectiveness and tolerability of second-line therapy with vildagliptin vs. other oral agents in type 2 diabetes: A real-life worldwide observational study (EDGE). International Journal of Clinical Practice, 2013. 67(10): p. 947-956. DOI: https://doi.org/10.1111/ijcp.12252.
15. Fadini, G.P., Zatti, G., Baldi, I., Bottigliengo, D., Consoli, A., Giaccari, A., Sesti, G., Avogaro, A., for the, D.-T.D.n., Use and effectiveness of dapagliflozin in routine clinical practice: An Italian multicentre retrospective study. Diabetes, Obesity and Metabolism, 2018. 20(7): p. 1781-1786. DOI: https://doi.org/10.1111/dom.13280.
16. Strain, W.D., Lukashevich, V., Kothny, W., Hoellinger, M.-J., Paldánius, P.M., Individualised treatment targets for elderly patients with type 2 diabetes using vildagliptin add-on or lone therapy (INTERVAL): a 24 week, randomised, double-blind, placebo-controlled study. The Lancet, 2013. 382(9890): p. 409-416. DOI: 10.1016/S0140-6736(13)60995-2.
17. Sicras-Mainar, A., Navarro-Artieda, R., Use of metformin and vildagliptin for treatment of type 2 diabetes in the elderly. Drug Des Devel Ther, 2014. 8: p. 811-818. DOI: 10.2147/DDDT.S65327.
18. McMurray, J.J.V., Ponikowski, P., Bolli, G.B., Lukashevich, V., Kozlovski, P., Kothny, W., Lewsey, J.D., Krum, H., Effects of Vildagliptin on Ventricular Function in Patients With Type 2 Diabetes Mellitus and Heart Failure: A Randomized Placebo-Controlled Trial. JACC: Heart Failure, 2018. 6(1): p. 8-17. DOI: https://doi.org/10.1016/j.jchf.2017.08.004.
19. Gregg, R. Bristol-Meyers-Squibb Investors Community Meeting, November 2004.
20. Ahrén, B., Landin-Olsson, M., Jansson, P.-A., Svensson, M., Holmes, D., Schweizer, A., Inhibition of Dipeptidyl Peptidase-4 Reduces Glycemia, Sustains Insulin Levels, and Reduces Glucagon Levels in Type 2 Diabetes. The Journal of Clinical Endocrinology & Metabolism, 2004. 89(5): p. 2078-2084. DOI: 10.1210/jc.2003-031907.
21. Karyekar, C.S., Ravichandran, S., Allen, E., Fleming, D., Frederich, R., Tolerability and efficacy of glycemic control with saxagliptin in older patients (aged ≥ 65 years) with inadequately controlled type 2 diabetes mellitus. Clin Interv Aging, 2013. 8: p. 419-430. DOI: 10.2147/CIA.S41246.
22. Scheen, A.J., Charpentier, G., Östgren, C.J., Hellqvist, Å., Gause-Nilsson, I., Efficacy and safety of saxagliptin in combination with metformin compared with sitagliptin in combination with metformin in adult patients with type 2 diabetes mellitus. Diabetes/Metabolism Research and Reviews, 2010. 26(7): p. 540-549. DOI: https://doi.org/10.1002/dmrr.1114.
23. Barnett, A.H., Huisman, H., Jones, R., von Eynatten, M., Patel, S., Woerle, H.-J., Linagliptin for patients aged 70 years or older with type 2 diabetes inadequately controlled with common antidiabetes treatments: a randomised, double-blind, placebo-controlled trial. The Lancet, 2013. 382(9902): p. 1413-1423. DOI: 10.1016/S0140-6736(13)61500-7.
24. Inzucchi, S.E., Nauck, M.A., Hehnke, U., Woerle, H.J., von Eynatten, M., Henry, R.R., Improved glucose control with reduced hypoglycaemic risk when linagliptin is added to basal insulin in elderly patients with type 2 diabetes. Diabetes, Obesity and Metabolism, 2015. 17(9): p. 868-877. DOI: https://doi.org/10.1111/dom.12490.
25. Rosenstock, J., Wilson, C., Fleck, P., Alogliptin versus glipizide monotherapy in elderly type 2 diabetes mellitus patients with mild hyperglycaemia: a prospective, double-blind, randomized, 1-year study. Diabetes, Obesity and Metabolism, 2013. 15(10): p. 906-914. DOI: https://doi.org/10.1111/dom.12102.
26. Pratley, R.E., McCall, T., Fleck, P.R., Wilson, C.A., Mekki, Q., Alogliptin Use in Elderly People: A Pooled Analysis from Phase 2 and 3 Studies. Journal of the American Geriatrics Society, 2009. 57(11): p. 2011-2019. DOI: https://doi.org/10.1111/j.1532-5415.2009.02484.x.
27. White, W.B., Cannon, C.P., Heller, S.R., Nissen, S.E., Bergenstal, R.M., Bakris, G.L., Perez, A.T., Fleck, P.R., Mehta, C.R., Kupfer, S., Wilson, C., Cushman, W.C., Zannad, F., Alogliptin after Acute Coronary Syndrome in Patients with Type 2 Diabetes. New England Journal of Medicine, 2013. 369(14): p. 1327-1335. DOI: 10.1056/NEJMoa1305889.