Азатиоприн – известный препарат для подавления иммунной системы, который применяют в трансплантологии для предотвращения отторжения пересаженных органов, в терапии аутоиммунных заболеваний (системная волчанка, болезнь Крона, рассеянный склероз и др.) и в дерматологии. Данный обзор преимущественно основан на результатах метаанализов клинических испытаний, и раскрывает эффективность азатиоприна при различных состояниях.
Азатиоприн, основные свойства
Азатиоприн (Имуран, AZA Azathioprine, Azamun, Azasan, Immuran, RORASUL, MURAN, Zytrim, 6-(1-метил-4-нитроимидазол-5-ил)тиопурин; C9H7N7O2S, молекулярная масса 277,26 Да; CAS 446-86-6) – это лекарственный препарат, подавляющий иммунную систему [1, 2]. Структурная формула азатиоприна показана на рисунке 1.
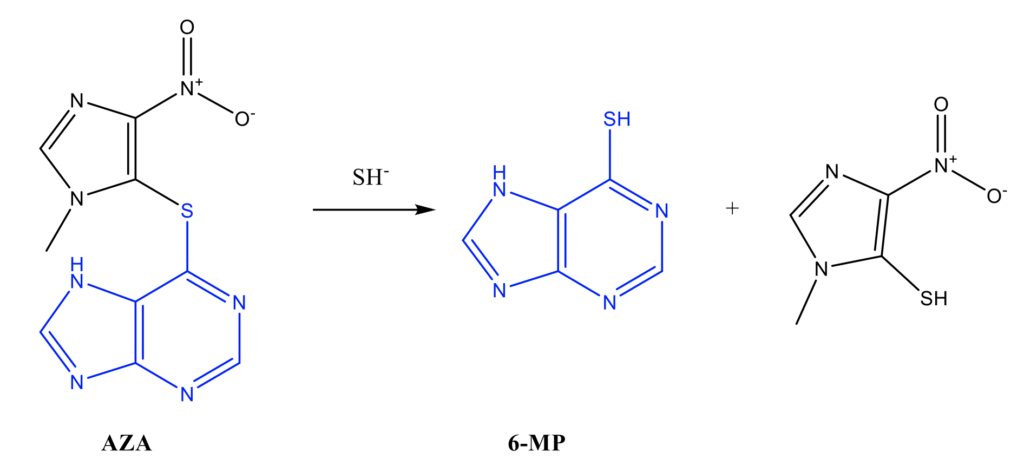
Рисунок 1 – Азатиоприн и активный метаболит
Азатиоприн широко применяют в трансплантологии и назначают при различных аутоиммунных заболеваниях, включая пузырчатку, системную красную волчанку, ревматоидный артрит, гепатит, воспалительное болезни кишечника, рассеянный склероз, атопический дерматит и пр. [2].
Азатиоприн по своей природе представляет собой пролекарство; молекула препарата в организме восстановительно расщепляется по тиоэфирной группе и превращается в 6-меркаптопурин (6-MP), его биоактивный метаболит (Рис. 1) [3]. Восстановителем является глутатион. Препарат препятствует биосинтезу аденина и гуанина, необходимых для включения в цепочку ДНК. Подавление синтеза пуринов сильнее всего влияет на быстрорастущие клетки, в том числе Т-клетки и В-клетки – важные компоненты иммунной системы.
Азатиоприн выпускают несколько производителей дженериков. Он продается под названиями Azasan от Salix в США, Imuran от GlaxoSmithKline в Канаде, США, Австралии и Великобритании, Azamun в Финляндии и Imurel в Скандинавии и Франции.
Азатиоприн получают из 6-MP и 1-метил-4-нитро-5-хлор-1H-имидазола, исходя из диэтилоксалата и метиламина [4, 5]. История препарата длинна, и начинается с того, что активный, но токсичный 6-MP был синтезирован в 1951 году Джорджем Хитчингсом (George Herbert Hitchings) и Гертрудой Элион (Gertrude Belle Elion) – лауреатами Нобелевской премии по физиологии и медицине 1988 года, которой их наградили за разработку рационального дизайна лекарственных препаратов [3, 6, 7]. Их труды положили основу созданию противовирусных препаратов для лечения СПИДа (зидовудин или азидотимидин), герпетической инфекции (ацикловир) и первого иммунодепрессанта, примененного в трансплантологии – азатиоприна, полученного в 1957 году; препарат обладает меньшей токсичностью, чем 6-MP, и сохраняет высокую активность. Азатиоприн внедрен в медицинскую практику одним из основателей трансплантации – Р. Калном (Roj Kaln) [8]. Впервые азатиоприн успешно применили в 1962 году при аллотрансплантации почки (пересадка органа между неродственными пациентами) [9]. Много лет азатиоприн в комбинации со стероидами был «золотым стандартом» для предотвращения отторжения.
Почти 88% азатиоприна всасывается в кишечнике. Его биодоступность очень индивидуальна – 30–90%. Высшие концентрации определяются спустя 1–2 часа [2], T½ 26–80 минут, метаболитов – до 5 часов. Побочные эффекты обусловлены особенностями действия препарата. Некоторые из известных – тошнота, истощение, выпадение волос и сыпь. Также встречаются миелодепрессия, макроцитоз, мегалобластный эритропоэз, нарушение функции печени, панкреатит, появление язв в ЖКТ и др. Так как азатиоприн действует подавляюще на спинной мозг, больные могут становиться восприимчивы к инфекционным заболеваниям. Следует соблюдать меры предосторожности при применении азатиоприн с аналогами или производными пурина, например, аллопуринола. 6-Меркаптопурин дезактивируется тиопурин-S-метилтрансферазой. Полиморфизм соответствующего гена обуславливает чрезмерную токсичность лекарства [10]. Азатиоприн включен в список канцерогенов [11].
Применение азатиоприна в современной медицине
Трансплантология
Азатиоприн применяют после введения аллотрансплантатов почек или печени, как правило, в сочетании с прочими методами (кортикостероиды, иммунодепрессанты, локальная радиотерапия) [12, 13]. Азатиоприн один раз в день в зависимости от массы тела (100 мг при массе тела <75 кг, 150 мг при 75 кг) столь же активен, как и микофенолат мофетила (по 1 г два раза в сутки), но его применение на порядок дешевле.
Азатиоприн и лечение ревматоидного артрита
Азатиоприн, как противоревматическое средство, модифицирующее течение болезни, применяли на взрослых пациентах, страдающих ревматоидным артритом, для уменьшения симптомов [14]. НПВП или стероиды и азатиоприн можно сочетать [11]. В анализ Кокран были включены три испытания с участием 81 пациента [14]. Сорок пациентов были рандомизированы в группы азатиоприна и 41 – в группу плацебо. Дозировка азатиоприна в этих исследованиях была обычно 2,0–3,0 мг/кг/день. Стандартизированная взвешенная средняя разница между лечением и плацебо составила -0,98. По результатам, организация Кокран пришла к выводу, что, учитывая высокое соотношение риска и пользы, нет доказательств, позволяющих рекомендовать использование азатиоприна по сравнению с аналогичными препаратами.
Воспалительные заболевания кишечника и азатиоприн
Болезнь Крона (БК) – воспалительное заболевание, характеризующееся хроническим прерывистым трансмуральным гранулематозным воспалением, приводящим к фиброзу кишечника, а также к стриктурам, главным образом в подвздошной кишке, что может привести к серьезным нарушениям во всем пищеварительном тракте и часто требует хирургического вмешательства. Заболевание имеет два пика заболеваемости среди населения; более крупный – у молодых людей в возрасте 20–30 лет и меньший – в возрасте 60 лет и старше, независимо от пола. Лечение болезни Крона является сложным, и во многих случаях пациенты не могут вернуться к своей обычной повседневной деятельности. Происхождение заболевания неизвестно, однако на его развитие влияют генетические, экологические, диетические и инфекционные факторы (вирусы и бактерии). Азатиоприн применяют в терапии кортикостероидозависимых пациентов с умеренной и тяжелой хронически активной болезнью Крона для обеспечения клинической ремиссии, и с фистулирующей формой заболевания [15]. Эффект появляется постепенно, выраженный ответ наступает не сразу. Применение азатиоприна в терапии болезни Крона сопряжено с увеличением риска развития лимфомы, однако точные причины неизвестны. Пониженные дозы препарата применяют в лечении детей со стероидно-зависимой болезнью Крона, а также для предотвращения обострения у больных с язвенным колитом.
Эффективность азатиоприна в поддержании ремиссии болезни Крона показана по результатам метаанализа в систематическом обзоре [15]. Из сорока исследований, в обзор вошли 12 (378 пациентов, сроки применения до двух лет, доза азатиоприна – 2 мг /кг/день). Препарат был эффективен для обеспечения стойкой ремиссии заболевания без рецидивов в большинстве случаев, особенно у тяжелых и среднетяжелых пациентов. Рецидивы наблюдались через 1–5 лет после отмены азатиоприна. Так, азатиоприн показал себя как эффективная терапия для сохранения ремиссии в рефрактерных (кортикостероидозависимых) и рецидивирующих случаях. Примерно у 40% пациентов ремиссия сохраняется на протяжении одного года. Побочное действие существенно не различались у пациентов, принимавших более низкие или более высокие дозы препарата (средняя идеальная доза: 2,5 мг/кг /день). Прекращение приема лекарства было связано с более высокими показателями рецидивов даже после длительных периодов ремиссии (4 года и более), поэтому при хорошей переносимости его не следует отменять. У пациентов со свищами и перианальными поражениями азатиоприн уменьшал необходимость в хирургических вмешательствах. Авторы заключают, что терапия должна быть индивидуализирована с учетом степени тяжести и с периодическим мониторингом крови, функции печени, поджелудочной железы и почек [15].
По результатам семилетнего наблюдения, азатиоприн оказался эффективен в поддержании ремиссии у пациентов с воспалительными заболеваниями кишечника [16]. Рекомендованная доза азатиоприна составляла 2–2,5 мг/кг. Препарат был прописан 433 пациентам со средним возрастом 35,6 лет, 236 (54,5%) из которых страдали болезнью Крона и 197 (45,5%) язвенным колитом. Через семь лет после начала лечения 50% пациентов все еще находились в ремиссии без стероидов (58,8% с болезнью Крона и 38,9% с колитом, соответственно), у 27,9% был рецидив, требующий повторного лечения со стероидами (20,6% и 37,2%, соответственно), 22,1% прекратили лечение из-за побочных эффектов. Потеря ответа с 1-го по 7-й год наблюдения была около 20%. Поддержание ремиссии без стероидов было значительно выше в случае болезни Крона. Возникновение нежелательных реакций, приводящих к отмене лечения, было низким [16].
Азатиоприн в терапии системной волчанке и других аутоиммунных состояниях
Азатиоприн нашел применение в терапии системной красной волчанки с рецидивирующими обострениями в дозировке от 15 мг, совместно с поддерживающим курсом преднизона после краткосрочной терапии циклофосфамидом и преднизоном [17]. Из 20 больных с чистым мембранозным нефритом, которые получали лечение по такому протоколу, у 11 пациентов была полная ремиссия, а у 7 пациентов произошло значительное улучшение в течение 12 месяцев терапии. Терапия азатиоприном 54 пациентов с тяжелым поражением почек или ЦНС связана с улучшением долгосрочной выживаемости.
Метаанализ рандомизированных клинических испытаний показал сравнительную эффективность и безопасность микофенолат мофетила (MMF, 1–2 г/день) и азатиоприна (1,5–3 мг/кг/день) в качестве поддерживающей терапии при волчаночном нефрите [18]. Авторами были отобраны четыре рандомизированных клинических испытания и одно долгосрочное исследование с участием 42–227 пациентов и сроком 12–72 месяца. Не было обнаружено значительных различий между MMF и азатиоприном в отношении стойкой ремиссии, рецидива, почечной недостаточности, повышения креатинина или смерти. Полученные данные не подтвердили превосходства MMF или азатиоприна в качестве поддерживающей терапии при волчаночном нефрите [18].
Позже было проведено многоцентровое исследование, сравнивающее циклоспорин (CsA), микофенолат мофетил (MMF) и азатиоприн в поддерживающей терапии подтвержденного биопсией активного волчаночного нефрита, с наблюдением через 8 лет [19]. Из 106 пациентов, 96,2% получали три пульс-терапии метилпреднизолона (MP) (500–1000 мг каждый) с последующим пероральным приемом преднизона 0,5–1 мг/кг/день, остальные – преднизон перорально 1 мг/кг в день в течение одного месяца, затем постепенно снижая дозу. Циклофосфамид (CYC) (ежемесячные пульс-терапии 0,5–1 г/м2 или перорально 1–2 мг/кг в течение трех месяцев) назначили 73,6% участников, MMF (целевая доза 2–3 г/день) или азатиоприн (начальная доза 2 мг/кг/день) 16% участников. Остальным пациентам вводили ритуксимаб или иммуноглобулины внутривенно. В качестве сопутствующей терапии все пациенты получали гидроксихлорохин и ингибиторы ангиотензинпревращающего фермента и/или блокаторы рецепторов ангиотензина II на протяжении всего исследования. Поддерживающая терапия: MMF – 2 г/день в течение первого года, затем снижается до 1,5 г/день. CsA – 4 мг/кг в сутки. По прошествии первого месяца дозу снижали на 0,5 мг/кг каждые 2 недели до 2,5–3,0 мг/кг в день в течение первого года, а затем – до 1,5 мг/кг/день. Азатиоприн – 2 мг/кг/сут. с понижением до 1,5 мг/кг/сут. через два месяца. После первого года средняя доза составила 1 мг/кг/день. Исходно, клинические и гистологические характеристики были сопоставимы между группами. К началу поддерживающей терапии у пациентов с CsA была значительно более высокая протеинурия или нефротический синдром и низкий CRR (23,5% против 55,5% для MMF и 41,7% для азатиоприна). Через год CRR был аналогичным в трех группах (79,4% для CsA, 63,8% для MMF, 58,3% для азатиоприна). Через 8 лет полная ремиссия почек была достигнута у 79,4% пациентов с CsA по сравнению с 83,3% пациентов с MMF и 77,8% пациентов с азатиоприном. Показатели 24-часовая протеинурия, креатинин сыворотки и проба Реберга-Тареева были одинаковыми. ХБП стадии 3 и выше развивалась у 8,8% пациентов с CsA, у 8,3% пациентов с MMF и у 8,3% пациентов с азатиоприном. Кривые выживаемости и частота побочных эффектов не различались. Таким образом, все виды лечения имели одинаковую эффективность в достижении и поддержании ремиссии [19].
Азатиоприн назначают как дополнительную терапию при пузырчатке и миастении, что позволяет снизить дозировку стероидов [20], однако сочетание с высокими дозами стероидов может увеличить риск оппортунистических инфекций. Начальная доза должна составлять 1 мг/кг с постепенным увеличением до 2–3 мг/кг. Азатиоприн применяют по 2 мг/кг/день для поддержания ремиссии при гранулематозе с полиангиитом [21].
Ретроспективный обзор 45 пациентов показал, что монотерапия азатиоприном оказалась эквивалентна двойной терапии в поддержании ремиссии при аутоиммунном гепатите [22]. Стандарт лечения включает монотерапию преднизоном или комбинацию преднизона и азатиоприна. Однако многие гепатологи в качестве альтернативы используют монотерапию азатиоприном, чтобы избежать побочных эффектов кортикостероидов. Средняя доза преднизона и азатиоприна составляла 5 мг и 100 мг, соответственно, в то время как средняя доза азатиоприна была 75 мг. У 93% всех пациентов сохранялась ремиссия, 80% группы двойной терапии и 95% группы монотерапии азатиоприном сохранили ремиссию. Результаты предполагают, что монотерапия азатиоприном эквивалентна двойной терапии преднизон-азатиоприн и сниженает риски длительной терапии кортикостероидами [22].
Эффективность азатиоприна в лечении рассеянного склероза
Азатиоприн широко использовался при рассеянном склерозе до середины 1990-ых годов, но из-за опасения повышенного риска злокачественных новообразований его применение сократилось [23]. Пять испытаний включали 698 пациентов: данные от 499 (71,5%) были доступны для анализа частоты рецидивов через один год, из 488 (70%) через два года и из 415 (59,5%) – три года. Азатиоприн снизил количество пациентов, у которых были рецидивы в течение первого года лечения (относительное снижение риска 20%), через два года (23%) и три года (18%). Возможный долгосрочный риск рака от азатиоприна может быть связан с продолжительностью лечения более десяти лет и кумулятивными дозами более 600 г.
Эффективность азатиоприна в лечении рассеянного склероза оценили метаанализом результатов опубликованных слепых рандомизированных контролируемых исследований [24]. В семи исследованиях участвовало 793 пациента. Через год применения 2–3 мг/кг/день азатиоприна увеличение баллов по шкале инвалидности не различалось в группах лечения и контрольной группе, но через 2 года наблюдалась небольшая разница в пользу азатиоприна и сохранилась через 3 года. Вероятность отсутствия рецидива в течение 1, 2 и 3 лет лечения была значительно выше в группе, получавшей азатиоприн [24].
Опыт использования азатиоприна при рассеянном склерозе в развивающихся странах показал, что у 2/3 пациентов, получавших азатиоприн по 0,7–2,5 мг/кг/день в течение 24 месяцев в не было рецидивов в течение двух лет. Побочных эффектов было немного, и они хорошо переносились, гематологический профиль не изменился [25].
Болезнь Паркинсона
Известно, что иммунная система участвует в этиологии и прогрессировании болезни Паркинсона. Воспаление и активация иммунной системы происходят как в головном мозге, так и на периферии, а профиль провоспалительных цитокинов связан с более быстрым клиническим прогрессированием. Риск развития болезни Паркинсона связан и с изменчивостью генов, связанных с иммунитетом, он снижается при использовании иммунодепрессантов. В настоящее время ведутся клинические исследования фазы II ISRCTN14616801 и EudraCT- 2018-003089-14, которые направлены на проверку гипотезы о влиянии иммунодепрессанта на болезнь Паркинсона [26]. В них будут вовлечены 60 участников с клиническими маркерами, указывающими на повышенный риск прогрессирования заболевания, которые будут проходить курс лечения азатиоприном, 1 мг/кг, против плацебо в течение 12 месяцев с последующим 6-месячным наблюдением [26]. Результаты исследования ожидаются в 2023 году.
Применение в дерматологии
Азатиоприн в США используется в дерматологии не по назначению, но в большинстве европейских стран его использование разрешено для лечения вульгарной пузырчатки и дерматомиозита [27]. Например, дерматологи уже почти 35 лет успешно используют азатиоприн для лечения иммунобуллезных заболеваний. Использование азатиоприна не по назначению в дерматологии рассмотрено в систематическом обзоре, для которого были отобраны 148 статьи [28]. Описанные дозировки азатиоприна составили 0,5–3,5 мг/кг/день с или без преднизолона, продолжительность лечения была в диапазоне 1–36 месяцев. Описана сильная клиническая рекомендация для использования азатиоприна в качестве альтернативного лечения атопического дерматита. Среднее улучшение по SASSAD (оценка степени тяжести атопического дерматита по шести признакам) на 26% (10 исследований, 319 пациентов) было обнаружено после трех месяцев лечения с 2,5 мг/кг азатиоприна [28]. Азатиоприн можно рассматривать как альтернативный вариант лечения тяжелого атопического дерматита, хотя его эффективность не так выражена, как у циклоспорина (улучшение SASSAD с 39% до 57%) [27].
Для буллезного пемфигоида сравнивали метилпреднизолон плюс азатиоприн с метилпреднизолоном плюс микофенолат мофетил. Результаты показали, что в обеих группах была достигнута 100% ремиссия и значительное снижение (45%) кумулятивной дозы преднизона в течение трехлетнего периода при добавлении азатиоприна. При хроническом актиническом дерматите у 14 пациентов на 1, 3 и 6 месяцах лечения среднее уменьшение количества высыпаний и степени высыпания и зуда по визуальной аналоговой шкале статистически различались между группами азатиоприна и плацебо. Состояние 57–92% пациентов значительно улучшилось. Для кожного васкулита, сравнивали преднизолон и азатиоприн (2,0 мг/кг/сут) с различными традиционными противоревматическими препаратами. В группе азатиоприна значительное уменьшение симптомов произошло через 18 месяцев; у 7 пациентов (88%) достигнута полная ремиссия, от 83% до 100% ответили на лечение азатиоприном и смогли снизить или отменить дозу преднизона. При контактном дерматите, вызываемом аллергенами растений 73% в группе азатиоприна (100 мг/сут) по сравнению с 72% в группе бетаметазона (2 мг/сут) имели отличный ответ на лечение, 45% имели рецидив в группе азатиоприна против 67% в группе бетаметазона. У пациентов с псориазом от умеренной до тяжелой степени, эритродермическим псориазом и/или псориатическим артритом примерно у 80% отмечалось заметное улучшение после терапии азатиоприном.
Известно о применении азатиоприна при склеродермии и витилиго [28], но, при этом, не рекомендуется комбинировать фототерапию с системными иммуномодулирующими препаратами из-за риска развития немеланомного рака кожи.
Другие хронические заболевания
Системные кортикостероиды и азатиоприн широко используются при хроническом гиперчувствительном пневмоните. В работе [29] азатиоприн вводили в дозе 2 мг/кг, максимальная доза – 150 мг в день. Прекращение лечения было необходимо у 43,5% пациентов, в основном из-за обострения заболевания (33,3%) и гепатотоксичности (25,9%). Из 62 пациентов 65 (56,5%) продолжали лечение через 2 года. Лечение азатиоприном было связано с улучшением форсированной жизненной емкости легких (FVC) на ~4% через 12 и 24 месяца. Также сообщалось о небольшом увеличении общей емкости легких (TLC) на 2–5% и в тесте с 6-минутной ходьбой (6MWT) до 10%, хотя по истечении двух лет статистических различий не наблюдалось [29].
Хронический невирусный миокардит (воспалительная кардиомиопатия) может требовать лечения с помощью подавления иммунитета с использованием комбинации преднизолона и азатиоприна (IPA). Однако эффекты иммуносупрессивного лечения непостоянны [30]. Метаанализ четырех испытаний с 369 пациентами продемонстрировал, что азатиоприн не улучшал показатели. В настоящее время недостаточно доказательств, подтверждающих функциональные и прогностические преимущества азатиоприна при вирус-отрицательной воспалительной положительной кардиомиопатии. Для изучения потенциальных эффектов азатиоприна необходимы дальнейшие исследования [30].
Заключение
Азатиоприн – давно известный иммунодепрессант, хорошо зарекомендовавший себя при лечении многих аутоиммунных заболеваний. Несмотря на широкое применение азатиоприна во всем мире, в России данный препарат сейчас практически недоступен, несмотря на то, что разрешен к применению [31]. Азатиоприн имеет действующую регистрацию (Р N001426/01-190312, субстанция – ЛСР-001774/09-100309), однако он не производится в РФ, и пациентам приходится ввозить его самостоятельно или прибегать к услугам посредников, что значительно повышает его конечную стоимость для потребителя. Остается надеяться, что эта ситуация изменитcя в ближайшем будущем.
1. Elks, J., Ganellin, C.R., Dictionary of Drugs: Chemical Data, Structures and Bibliographies, ed. J. Elks, Ganellin, C.R. 1990, Boston, MA: Springer US. p. 474.
2. Азатиоприн (Azathioprine). 2020; Available from: https://www.rlsnet.ru/mnn_index_id_321.htm.
3. Elion, G.B., Nobel lecture in physiology or medicine—1988. The purine path to chemotherapy. In Vitro Cell Dev Biol, 1989. 25(4): p. 321-330. DOI: 10.1007/bf02624593.
4. US 3056785 A, 1962.
5. Blicke, F.F., Godt, H.C., Diuretics. I. 3-Substituted Paraxanthines. Journal of the American Chemical Society, 1954. 76(14): p. 3653-3655. DOI: 10.1021/ja01643a015.
6. Elion, G.B., Callahan, S.W., Hitchings, G.H., Rundles, R.W., The metabolism of 2-amino-6-[(1-methyl-4-nitro-5-imidazolyl)thio]purine (B.W. 57-323) in man. Cancer chemotherapy reports, 1960. 8: p. 47-52.
7. Elion, G.B., The purine path to chemotherapy. Science, 1989. 244: p. 41-47. DOI: 10.1126/science.2649979.
8. Calne, R.Y., The rejection of renal homografts. The Lancet, 1960. 275(7121): p. 417-418. DOI: 10.1016/S0140-6736(60)90343-3.
9. Murray, J.E., Merrill, J.P., Harrison, J.H., Wilson, R.E., Dammin, G.J., Prolonged Survival of Human-Kidney Homografts by Immunosuppressive Drug Therapy. New England Journal of Medicine, 1963. 268(24): p. 1315-1323. DOI: 10.1056/NEJM196306132682401.
10. Konstantopoulou, M., Belgi, A., Griffiths, K.D., Seale, J.R.C., Macfarlane, A.W., Azathioprine-induced pancytopenia in a patient with pompholyx and deficiency of erythrocyte thiopurine methyltransferase. BMJ, 2005. 330(7487): p. 350. DOI: 10.1136/bmj.330.7487.350.
11. National Toxicology Program. „Azathioprine”. Substance Profiles, Report on Carcinogens (Eleventh Ed.). U.S. Department of Health and Human Services. 2010; Available from: https://web.archive.org/web/20090730071449/http://ntp.niehs.nih.gov/ntp/roc/toc11.html.
12. Nuyttens, J.J., Harper, J., Jenrette, J.M., Turrisi, A.T., III, Outcome of radiation therapy for renal transplant rejection refractory to chemical immunosuppression. Radiotherapy and Oncology, 2005. 74(1): p. 17-19. DOI: 10.1016/j.radonc.2004.08.011.
13. Remuzzi, G., Lesti, M., Gotti, E., Ganeva, M., Dimitrov, B.D., Ene-Iordache, B., Gherardi, G., Donati, D., Salvadori, M., Sandrini, S., Valente, U., Segoloni, G., Mourad, G., Federico, S., Rigotti, P., Sparacino, V., Bosmans, J.-L., Perico, N., Ruggenenti, P., Mycophenolate mofetil versus azathioprine for prevention of acute rejection in renal transplantation (MYSS): a randomised trial. The Lancet, 2004. 364(9433): p. 503-512. DOI: https://doi.org/10.1016/S0140-6736(04)16808-6.
14. Suarez-Almazor, M.E., Spooner, C., Belseck, E., Azathioprine for treating rheumatoid arthritis. Cochrane Database Syst Rev, 2000(4): p. CD001461. DOI: 10.1002/14651858.cd001461.
15. da Silva Coelho, M.C., Botelho, A.C.P., Bruno, P.B., Effectiveness of Azathioprine in Maintaining Remission in Crohn’s Disease: A Systematic Review. Gastroenterology, Hepatology & Digestive Disorders, 2019. 2(1): p. 1-6.
16. Cassieri, C., Mastromatteo, A.M., Pica, R., Zippi, M., Corazziari, E.S., Paoluzi, P., Lecca, G.P., Vernia, P., Brandimarte, G., Nasi, G., Azathioprine in the maintainance remission in inflammatory bowel disease patients: 7-year follow up. European Journal of Public Health, 2020. 30(Supplement_5). DOI: 10.1093/eurpub/ckaa166.591.
17. Abu-Shakra, M., Shoenfeld, Y., xAzathioprine therapy for patients with systemic lupus erythematosus. Lupus, 2001. 10(3): p. 152-153. DOI: 10.1191/096120301676669495.
18. Maneiro, J.R., Lopez-Canoa, N., Salgado, E., Gomez-Reino, J.J., Maintenance therapy of lupus nephritis with mycophenolate or azathioprine: systematic review and meta-analysis. Rheumatology, 2014. 53(5): p. 834-838. DOI: 10.1093/rheumatology/ket429.
19. Argolini, L.M., Frontini, G., Elefante, E., Saccon, F., Binda, V., Tani, C., Scotti, I., Carli, L., Gatto, M., Esposito, C., Gerosa, M., Caporali, R., Doria, A., Messa, P., Mosca, M., Moroni, G., Multicentric study comparing cyclosporine, mycophenolate mofetil and azathioprine in the maintenance therapy of lupus nephritis: 8 years follow up. Journal of Nephrology, 2020. DOI: 10.1007/s40620-020-00753-w.
20. Richman, D.P., Agius, M.A., Treatment of autoimmune myasthenia gravis. Neurology, 2003. 61(12): p. 1652. DOI: 10.1212/01.WNL.0000098887.24618.A0.
21. Singer, O., McCune, W.J., Update on maintenance therapy for granulomatosis with polyangiitis and microscopic polyangiitis. Current Opinion in Rheumatology, 2017. 29(3).
22. McNally, B.B., Carey, E.J., Azathioprine Monotherapy Is Equivalent to Dual Therapy in Maintaining Remission in Autoimmune Hepatitis. Digestive Diseases and Sciences, 2020. DOI: 10.1007/s10620-020-06347-7.
23. Casetta, I., Iuliano, G., Filippini, G., Azathioprine for multiple sclerosis. Cochrane Database of Systematic Reviews, 2007(4). DOI: 10.1002/14651858.CD003982.pub2.
24. Yudkin, P.L., Ellison, G.W., Ghezzi, A., Goodkin, D.E., Hughes, R.A.C., McPherson, K., Mertin, J., Milanese, C., Overview of azathioprine treatment in multiple sclerosis. The Lancet, 1991. 338(8774): p. 1051-1055. DOI: https://doi.org/10.1016/0140-6736(91)91909-E.
25. Rahmawati, M.B., Experience in using azathioprine for multiple sclerosis in developing country: A preliminary study. Journal of the Neurological Sciences, 2019. 405: p. 275-276. DOI: https://doi.org/10.1016/j.jns.2019.10.1334.
26. Greenland, J.C., Cutting, E., Kadyan, S., Bond, S., Chhabra, A., Williams-Gray, C.H., Azathioprine immunosuppression and disease modification in Parkinson’s disease (AZA-PD): a randomised double-blind placebo-controlled phase II trial protocol. BMJ Open, 2020. 10(11): p. e040527. DOI: 10.1136/bmjopen-2020-040527.
27. Singh, G., Gautam, S., Gupta, A., Saini, P., Reported Adverse Drug Reactions in Off–Label Use of Azathioprine in Dermatology: A Review. Indian Journal of Public Health Research Development, 2020. 11(2): p. 779-783.
28. Schram, M.E., Borgonjen, R.J., Bik, C.M.J.M., van der Schroeff, J.G., van Everdingen, J.J.E., Spuls, P.I., for the Off-Label, W., Project Group of the Dutch Society of, D., Venereology, Off-label Use of Azathioprine in Dermatology: A Systematic Review. Archives of Dermatology, 2011. 147(4): p. 474-488. DOI: 10.1001/archdermatol.2011.79.
29. Terras Alexandre, A., Martins, N., Raimundo, S., Melo, N., Catetano Mota, P., Novais e Bastos, H., Pereira, J.M., Cunha, R., Guimarães, S., Souto Moura, C., Morais, A., Impact of Azathioprine use in chronic hypersensitivity pneumonitis patients. Pulmonary Pharmacology & Therapeutics, 2020. 60: p. 101878. DOI: https://doi.org/10.1016/j.pupt.2019.101878.
30. Timmermans, P., Barradas-Pires, A., Ali, O., Henkens, M., Heymans, S., Negishi, K., Prednisone and azathioprine in patients with inflammatory cardiomyopathy: systematic review and meta-analysis. ESC Heart Failure, 2020. 7(5): p. 2278-2296. DOI: https://doi.org/10.1002/ehf2.12762.
31. Какое им дело до вашей жизни. 2020; Available from: https://novayagazeta.ru/articles/2020/07/15/86278-kakoe-im-delo-do-vashey-zhizni.